Omega oxidace tuků jako prevence civilizačních onemocnění?
Omega oxidace tuků, co to je? Pravděpodobně jste tento pojem ještě nikdy neslyšeli, dokonce si myslím, že ani většina profesionálů v oboru tento pojem nezná nebo ho již dávno vypustili z paměti jako nepodstatnou informaci. Pokusím se zde vysvětlit, proč si myslím, že právě omega oxidace, respektive nedostatečná aktivace tohoto metabolického procesu, je kořenovou příčinou civilizačních nemocí, včetně rakoviny.
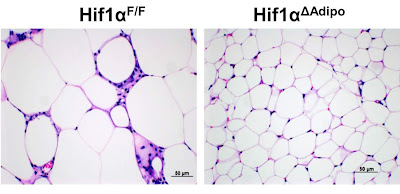
Začneme ale zvolna. V jednom z předchozích příspěvků jsem vysvětloval činnost tukové buňky. Dokud nedojde k jejímu přetížení nadbytkem paliva, volných mastných kyselin (FFA / NEFA) nebo glukózy, buňka pracuje normálně. Pokud je paliva víc, ukládá se jako tuk, pokud je ho málo, uvolňuje tuk do krevního oběhu. Velice užitečná činnost. Studie na myších nám ale ukazují, že pokud jim místo standardní stravy podáváme hodně tučnou stravu, myši tloustnou a budou obézní. Jejich tukové buňky se mnohonásobně zvětší (levý obrázek), přestanou správně pracovat, budou signalizovat zánět a přebytečné palivo začnou vypouštět ve formě laktátu.
To je známý fakt, který ve výsledku vedl ke špatným doporučením. Už v tomto příspěvku vysvětluji, co je na tom špatně. Ale pokračujme, vypouštění nadbytečného paliva ve formě laktátu znamená, že byl aktivován stav pseudohypoxie, byl aktivován transkripční faktor HIF-1α, byla tedy také aktivovaná zvýšená tvorba a ukládání tuků. To vysvětluje nadměrné zvětšení tukových buněk. Co spustilo HIF-1α, když to nebyl nedostatek kyslíku? Co spustilo jeho stabilizaci? Jak se stalo, že HIF-1α nebyl označen hydroxylovou skupinou -OH pomocí enzymu PHD, prolyl hydroxylázy? Co ovlivňuje činnost enzymu PHD? Ukazuje se, že činnost PHD lze zastavit naakumulováním vedlejšího produktu činnosti PHD, tím je nám již dobře známá kyselina jantarová, neboli sukcinát, meziprodukt TCA (Krebsova, citrátového) cyklu.
Normálně fungující buňka je schopna snadno odstraňovat vedlejší produkt hydroxylace, sukcinát, pomocí enzymu SDH, sukcinát dehydrogenázy, neboli mitochondriálního komplexu II. Jakýkoli problém s činností druhého mitochondriálního komplexu tedy zvyšuje pravděpodobnost spuštění pseudohypoxie. My už také víme, že zpomalení až zastavení lze vyvolat pomocí malonátu, falešného substrátu, který se váže na vstupní místo SDH místo sukcinátu a znemožní mu funkci. Další látkou, která může potenciálně zastavit činnost je nadbytek výsledného produktu, tím je FADH2. Možná lze celou tuto chemickou reakci otočit pomocí přebytku FADH2. Jak to celé souvisí s metabolismem tuků? Zcela zásadně.
Ale než si to vysvětlíme, podíváme se ještě na jednu studii, kterou nedávno komentoval na svém blogu Georgi Dinkov. Ta totiž ukazuje, podobně, jako můj předchozí příspěvek, že v určitých situacích buňka používá zkratky. Procesy, které normálně probíhají uvnitř mitochondrie, jsou nahrazeny procesy probíhajícími v cytosolu, buněčné plazmě.
Tak lze najít metabolické cykly podobné TCA cyklu, které ale nepotřebují kyslík, ale ani neprodukují laktát. Zato rozkládají a vytvářejí tuky, přitom využívají energii z glykolýzy. Řada procesů TCA cyklu je při tom zastavena, nebo dokonce probíhá opačným směrem. Tak lze přesunout meziprodukty TCA cyklu ven a využít je k převedení NADH na NAD+ místo fermentace pyruvátu na laktát k zajištění kontinuálního rozkladu glukózy a tedy zajištění energie ATP. Tyto procesy mají společné to, že nevyužívají druhý mitochondriální komplex SDH. Aktivují tedy pseudohypoxii a jsou jí dále udržovány, protože HIF-1 aktivuje tvorbu tuků, která celý tento cyklus udržuje v chodu. Stejný stav také vypíná systém regulace vstupu dlouhých mastných kyselin do mitochondrie, protože ten je také závislý na činnosti PHD, jedná se tedy o procesy, které jsou limitovány pouze dostupností paliva a to je velmi, velmi nebezpečné.
Pokud se tedy aktivují procesy popsané v předchozím odstavci, beta oxidace tuků probíhá na plné obrátky, ale výsledné meziprodukty nikdy nebudou zoxidovány a vypuštěny ve formě CO2 a vody, ale budou uloženy jako nový tuk. Přitom vznikne mnoho molekul FADH2, ty pravděpodobně otočí směr SDH k tvorbě sukcinátu z malátu, takže aktivace HIF-1 je trvalá a nebude jednoduché obnovit původní zdravé procesy. Také vznikne mnoho molekul NADH, které otočí směr části TCA cyklu tak, že bude produkován citrát z α-ketoglutarátu. A citrát je normálně hlavní brzda nadměrného příjmu paliva, ale je to také surovina pro tvorbu tuků, je tedy intenzivně odebírán a nemůže tedy jako brzda fungovat. Toto je metabolismus rakoviny, takto ho vidí autoři již zmíněné studie.
Opustili jsme tukové buňky myší, které nezřízeně nabývaly na váze při tučné stravě. Autoři studie ale skupinu myší geneticky upravili tak, že jim znefunkčnili HIF-1 selektivně pouze v tukových buňkách. Co se stalo? Tučná strava myším přestala vadit, žádné nadměrné tloustnutí, žádná inzulinová rezistence ani problémy s krevním cukrem, prostě nic (pravý obrázek tukových buněk). Tučná strava byla najednou pro takto upravené myši zcela zdravá. Jak si to vysvětlit?
Už možná tušíte. Pokud tuky zpomalí nebo zastaví činnost SDH, tedy druhého mitochondriálního komplexu, zbytek už zajistí aktivace HIF-1 přes akumulaci sukcinátu. Pokud HIF-1 zůstane vypnutý jako u upravených myší, nic špatného se neděje. A co třeba u člověka? Chcete vypnout HIF-1? Já bych vám to neradil. My přece nemusíme geneticky vypínat HIF-1 v tukové tkáni. Stačí zajistit dostatečnou aktivitu enzymu SDH. Nic víc není třeba, navíc my už dokonce víme, jak to lze provést. Stačí zajistit dostatek substrátu pro aktivaci SDH, tedy sukcinát. Sukcinát navíc není jen substrátem, ale prostřednictvím receptoru ovládá zřejmě mnoho procesů. Jisté je, že sukcinát funguje jako prostředek pro zastavení pseudohypoxie a pro obnovení normální reakce na skutečný nedostatek kyslíku. To už jsme si ukázali na příkladu infarktu.
Vraťme se nyní k omega oxidaci. Mastné kyseliny jsou tvořeny uhlíkovými řetězci, které mají na jednom konci karboxylovou skupinu -COOH. Mohou být metabolizovány v mitochondriích nebo v peroxizomech. Dlouhé, střední a krátké se zpracovávají v mitochondriích. Peroxizomy zpracovávají hlavně dlouhé a velmi dlouhé mastné kyseliny (a ještě raději zpracovávají nenasycené a polynenasycené a také dikarboxylové). Výsledným produktem beta oxidace je molekula acetyl-CoA a příslušný počet molekul NADH a FADH2 (nebo NADH->malát/laktát a FADH2->H2O2 v peroxizomech), žádná ATP. Část mastných kyselin, zejména středních délek, je ještě před vstupem do mitochondrie upravena omega oxidací a i druhý konec je pak zakončený karboxylovou skupinou -COOH, nazývají se dikarboxylové kyseliny a jsou tak přesněrovány do peroxizomů. Výsledným produktem beta oxidace pak není acetyl-CoA, ale acetát, sukcinát a sukcinyl-CoA, který vstupuje do TCA cyklu na opačné straně a zajistí činnost SDH. Udržování SDH v činnosti je životně důležité právě při metabolismu tuků, proto je třeba udržovat vždy vhodný poměr středních a krátkých řetězců mastných kyselin k dlouhým řetězcům. Střední řetězce totiž aktivují omega oxidaci, a to i dlouhých mastných kyselin. Kdyby ve studii na geneticky upravených myších použili část tuků se středně dlouhými řetězci, nemuseli by pravděpodobně myši geneticky upravovat. Zda to tak skutečně je, to ukáže budoucnost, snad takové studie budou provedeny. Preventivní účinek MCT proti metabolickým problémům byl již ve studiích prokázán, jen zatím nikdo neobjasnil, proč to funguje. Navíc víme, že omega oxidace se zvyšuje při půstu. Evidentně tělo samotné ví, že pokud má spalovat tuky, potřebuje omega oxidaci. Také obyčejná kyselina acetylsalicylová (Acylpyrin) zvyšuje omega oxidaci, což je možná její nejdůležitější, byť prakticky neznámý, účinek. Dokonce takový, že Acylpyrin významné snižuje riziko rakoviny.
Doplnění:
Omega oxidace saturovaných tuků zvyšuje produkci acetátu (octanu) spalováním dikarboxylových mastných kyselin v peroxizomech, takže aktivuje enzym AMPK a blokuje syntézu tuků a podporuje jejich spalování v mitochondriích. To je asi ještě mnohem důležitější, než produkce sukcinátu (kyseliny jantarové).
Zdroje:
A “Weird” Mitochondrial Fatty Acid Oxidation as a Metabolic “Secret” of Cancer
Contribution of omega-oxidation to fatty acid oxidation by liver of rat and monkey
PHD3 Loss in Cancer Enables Metabolic Reliance on Fatty Acid Oxidation via Deactivation of ACC2
Induction of Omega-Oxidation of Monocarboxylic Acids in Rats by Acetylsalicylic Acid
A large cohort study of long-term daily use of adult-strength aspirin and cancer incidence
Supplement of Succinate Reduces Lipid Deposition and Improves Metabolic Function in Obese Mice




Komentáře
Okomentovat