Stárnutí jako postupná pseudohypoxie?
Na pojem hypoxie jsme zde již narazili, je to stav nedostatku kyslíku. Každá zdravá buňka se umí včas na tento stav připravit, umí zapnout a vypnout potřebné geny a krátkodobý nebo mírný nedostatek kyslíku snadno přežije. Co je to ale pseudohypoxie? Můžeme si to představit tak, že buňka dostane signál, že kyslíku je málo a spustí potřebné mechanizmy. Ve skutečnosti ale je tento signál falešný a tak může buňku poškodit. Stejný jev bývá také označován jako aerobní glykolýza nebo podle svého objevitele jako Warburgův efekt.
K těmto úvahám dospěli autoři jedné studie, protože si všimli nápadné podobnosti v chování starších buněk a buněk vystavených nedostatku kyslíku. Podívejme se ale nejprve na jinou studii.
Jak se projevuje nedostatek kyslíku, co provede hypoxie s metabolismem?
Tato studie sleduje vliv hypoxie na metabolizmus tuků.
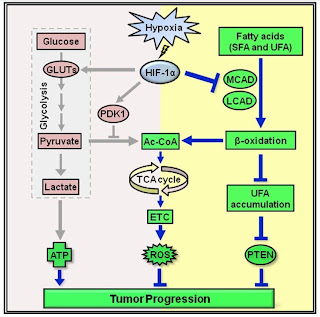
Z grafů výše lze vyčíst několik zajímavých poznatků. Enzymy MCAD a LCAD jsou základní stroječky pro rozebrání mastných kyselin v mitochondriích, LCAD rozebírá hlavně dlouhé nenasycené a MCAD dlouhé nasycené mastné kyseliny. Vliv na aktivitu těchto enzymů a tím na metabolizmus tuků má už samotný meziprodukt HIF-1α (na grafu sh1a znamená jeho odstranění i odstranění efektu hypoxie), o kterém jsem už psal zde. Ten lze stabilizovat, jak už víme, pouze při přítomnosti peroxidu vodíku, což je produkt dismutace superoxidu pomocí superoxid dismutázy (SOD) a který je odbouráván pomocí glutathion peroxidázy (GPx) při převodu redukovaného glutathionu (GSH) na GSSG. Hladina peroxidu tedy stoupá s vyšší aktivitou SOD a klesá s vyšší aktivitou GPx a stoupá při nedostatku GSH. Na horním grafu je jasně vidět, že stabilizace HIF-1α, tedy hypoxie, nejen omezuje rozebírání tuků, ale také aktivuje tvorbu nových tuků (enzymy FASN, SCD1 aj). Je zcela druhořadé, jestli ke stabilizaci HIF-1α dojde vlivem skutečného nedostatku kyslíku nebo jen falešnou signalizací.
Tím se dostáváme k jádru věci. Totiž problému, jak je vyvolána falešná signalizace hypoxie i při dostatku kyslíku? Podívejte se na předchozí příspěvek. Stačí k tomu například nedostatek redukovaného glutathionu (GSH) v prostředí přebytku volných mastných kyselin (FFA) v krvi.
A nyní se můžeme vrátit k první studii, která zkoumala stárnutí myší a dospěla k závěru, že pseudo hypoxie spojená se stárnutím je způsobena nedostatkem NAD+. Pokud jste si někdy pustili nějaké YouTube video týkající se snah prodlužovat život, určitě jste se již setkali s názorem, že chybějící NAD+ je nutné doplňovat pomocí různých doplňků stravy, jako je vitamin B3 (niacin, NA), NAM, NAC, NR, NMN a další. To, že při metabolických problémech dochází ke změně poměru hladin NAD+/NADH je jasné. Je to vlastně přebytek paliva NADH při nedostatečném spalování (oxidační fosforylace), nedostatečná funkce elektronového transportního řetězce (ETC), tedy některého z mitochondriálních komplexů I až V. Málokdo se ale zabývá skutečnými příčinami tohoto stavu.
V této studii zjistili, že dochází k poklesu exprese mitochondriálních enzymů zajišťujících získávání energie za pomoci kyslíku. Navíc potvrdili, že to je způsobeno nedostatkem NAD+ v jádru buňky a tento nedostatek lze částečně napravit jeho doplněním a to vede i k obnovení aktivity mitochondriálních enzymů a dojde také ke správnému označkování a odstranění signálu hypoxie HIF-1α. Mohlo by se tedy zdát, že tato suplementace prodlužuje život. Na to ale zatím důkazy nejsou a možná ani nebudou.
Zopakujme sí, jak buňka získává NAD+? Hlavním zdrojem je elektronový transportní řetězec, tedy získávání energie spalováním za pomoci kyslíku. Dalšími menším, tedy náhradními zdroji, jsou fermentace glukózy na kyselinu mléčnou (laktát) a také vyšší desaturace nenasycených mastných kyselin, konkrétně linolové kyseliny. Pokud tedy je ve stavu pseudohypoxie zvýšená produkce laktátu, je to vlastně obrana, záporná zpětná vazba a způsob, jak obnovit hladinu NAD+.
Posloupnost příčin může být tedy i opačná, Jak to tedy je? Je nedostatek NAD+ příčinou pseudohypoxie nebo jejím následkem? Není nedostatek NAD+ nejprve způsobený spíše nedostatečnou adaptací na skutečnou hypoxii, nespuštěním fermentace, která by NAD+ snadno obnovila? Nedostatek NAD+ by pak mohl způsobit změny v expresi genů a pseudohypoxii i po obnovení hladiny kyslíku. Hlavním regulačním signálem by pak mohl být právě signál HIF-1α. Znovu si zopakujme, jakým způsobem se odbourává, protože nedostatečné odbourávání vyvolá právě stav pseudohypoxie a tedy stárnutí a přílišné odbourávání by mohlo tento stav spustit.
Transkripční faktor HIF-1α je syntetizován vždy. Aby mohl být za normální situace odstraněn, musí být označen značkou OH, při hypoxii však ne. Další enzymy jako např. VHL (Von Hippel-Lindau) potom zajistí jeho odstranění nebo ne. Je třeba ovšem vzít v úvahu výsledky jiné studie, ve které autoři zjistili, že i toto odbourávání lze velmi silně ovlivnit. Zjistili, že při dostatečné hladině peroxidu vodíku k žádné degradaci HIF-1α nemusí dojít ani když je správně označen. Nebo naopak vysokou aktivitou glutathion peroxidázy lze reakci na hypoxii vymazat, HIF-1α se odbourá i při hodně nízké hladině kyslíku, to zcela určitě vyvolá nedostatek NAD+, protože oxidační fosforylace nebude probíhat, ale fermentace se nespustí. A tady je háček, doplníme-li NAD+ ve stavu vysoké aktivity glutathion peroxidázy, vyvolaném vysokou hladinou volných mastných kyselin a po vyčerpání zásob redukovaného glutathionu, tedy ve stavu inzulínové rezistence, bude to mít nějaký efekt? Kde je tedy příčina pseudohypoxie?
Obávám se, že samotné doplnění NAD+ nestačí. Navíc je zjištěno, že například vitamín B3 (niacin, nikotinová kyselina, NA) sice funguje krátkodobě, ale dlouhodobě působí tak, že zvýší hladinu volných mastných kyselin, to se ale dostáváme do výchozího stavu nebo stavu ještě horšího než předtím. To opravdu nelze doporučit. Nevím, jak konkrétně ovlivňují metabolizmus tuků ostatní látky používané na doplnění NAD+, ale jelikož se o hladinu volných mastných kyselin autoři studií vůbec nezajímají, neměří je, pak bych byl skeptický a opatrný.
Existuje jeden další zajímavý doplněk, jmenuje se melatonin. Nemám ještě nastudován dostatek informací, tak se pouze zmíním, co zjistil autoři této studie. Podařilo se jim na myším modelu zpomalit růst nádoru plic tím, že obnovili činnost mitochondriálních komplexů elektronového transportního řetězce a tak obnovili získávání energie spalováním za pomoci kyslíku. Snížili fermentaci glukózy na laktát a objasnili i procesy, které to způsobují. A to pouze doplňováním melatoninu, zní to velmi slibně, že?
Zdroje:
Oxygen sensing requires mitochondrial ROS but not oxidative phosphorylation
Polyunsaturated Fatty Acid Desaturation Is a Mechanism for Glycolytic NAD + Recycling
Role of pseudohypoxia in the pathogenesis of type 2 diabetes




Komentáře
Okomentovat