Záhada chybějící molekuly acetyl-CoA, acetát/ocet jako řešení?
Co je to cytosolický acetyl-CoA? Všichni známe ocet, to je kyselina obsahující dva uhlíky, nejkratší mastná kyselina. Už jsme se zde setkali s MCT oleji, které obsahují střední mastné kyseliny s osmi nebo deseti uhlíky, kokosový olej obsahuje kyselinu laurovou s dvanácti uhlíky. Pokud tedy půjdeme směrem k menšímu počtu uhlíků, dostaneme se k butyrátu obsaženém v másle, mastné kyselině se čtyřmi uhlíky, a ke kyselině octové se dvěma uhlíky. Pokud je kyselina rozpuštěna ve vodě, oddělí se vodík jako proton a mluvíme častěji o molekule acetátu, butyrátu, oleátu apod. nikoli o kyselině jako takové. To jen tak na úvod.
Co je ale acetyl-CoA? Acetát je malá molekula, aby buňka mohla řídit tok těchto malých molekul, připojuje k nim část nazvanou koenzym A zkrácené CoA. Proces připojování acetátu ke CoA vyžaduje energii (ATP) a je to vlastně aktivace molekuly acetátu pro použití v buňce. Dokonce tento proces vyšle signál (AMP) pro podpoření výroby energie (aktivuje AMPK). Tento proces ale takto probíhá pouze při přítomnosti acetátu. Pokud acetát není k dispozici, používá se jiná, komplikovanější cesta.
Molekuly acetyl-CoA jsou běžné, jsou vyráběny neustále v procesu zpracování sacharidů, proteinů i tuků. Ale toto probíhá uvnitř mitochondrií, v buněčných organelách pro výrobu ATP. Pokud se ATP vytváří v buněčné plazmě, tedy cytosolu, žádný acetyl-CoA nevzniká. Jsou pouze dvě cesty, jak se acetyl-CoA dostane do cytosolu. První trasu už jsem zmínil, z acetátu enzymem ACSS2. Druhá trasa je z citrátu vypuštěného z mitochondrie zpracovaného pomocí enzymu ACLY. Podmínkou tedy je fungující metabolizmus v mitochondriích (TCA cyklus), přebytek citrátu takový, že je vypouštěn ven a navíc je to podmíněno i dostatkem cytosolického malátu, který slouží pro výměnný obchod s mitochondrií za citrát. Je to tedy dost složité. Navíc pokud ACLY vyrobí acetyl-CoA, může ho odebírat buď tvorba nových tuků (ACC) nebo cesta pro výrobu NADPH pomocí isocitrát dehydrogenázy. Takže i pokud se vyrobí, může chybět z důvodu nadměrné spotřeby. Ale proč vlastně řeším dostupnost cytosolického acetyl-CoA?
Našel jsem jednu velmi zajímavou studii, když jsem se snažil najít mechanismus, kterým krátké mastné kyseliny pozitivně působí na metabolizmus. Zopakujme si zde krátce, co vše umí doplňování acetátu ke stravě myší. Stačí přidat 5 hmotnostních procent octanu sodného do stravy myší aby vůbec netlously na tučné stravě! Navíc je dokonce můžeme nechat ztloustnout bez octanu a potom jim přidat do stravy octan a myši samy zhubnou, a to bez žádného omezení kalorií, mohou jíst kolik chtějí. Velká záhada, že?
 |
| PPAR-gamma je ovládán transkripčním faktorem HIF-1α. |
Takže když jsem pátral po možném mechanizmu, jak to je možné, nalezl jsem studii, která ukazuje, jak lze aktivovat transkripční faktor HIF-1α, tedy signalizaci nedostatku kyslíku, i v situaci, kdy kyslíku je dostatek, tzv. normoxii. Už jsem zde ukazoval, jak aktivace HIF-1α ovládá tzv. hypertrofii tukových buněk, jejich zvětšování. Stačí geneticky vypnout HIF-1α a tukové buňky zůstanou malé. Právě nemocné velké tukové buňky způsobují změny v celém organizmu, vysílají signály, které způsobí poškození dalších orgánů, zejména jater, ale mohou podporovat i vznik rakoviny.
Studie nám ukazuje, že při normoxii je důležité zachovat dostatek cytosolického acetyl-CoA a tedy fungující acetylaci molekul, v tomto případě acetylaci molekul HIF-1α. Takto jsou označkovány pro zničení a jsou tedy odstraňovány. Je to tedy stejné jako genetické vypnutí HIF-1α. A ve studii nám autoři ukazují, že lze vyvolat nedostatek acetyl-CoA přidáním glutaminu, aminokyseliny, která při zpracování uvolňuje čpavek, ten mění pH v cytosolu a aktivace HIF-1α umožní srovnat pH pomocí vypouštění laktátu a přeměnou CO2 na bikarbonát.
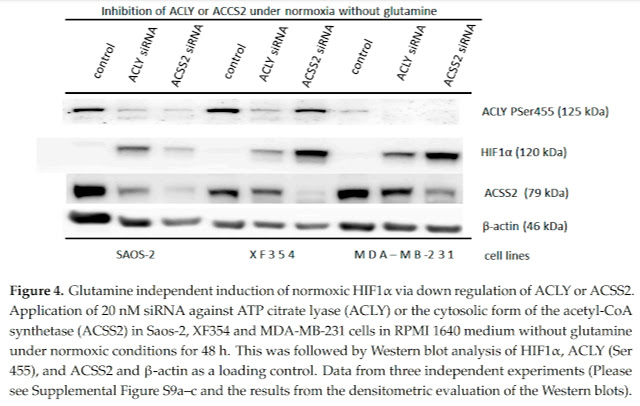 |
| HIF-1a je aktivován při normoxii na třech buněčných kulturách při vypnutí ACLY (ACLY siRNA) nebo ACSS2 (ACSS2 siRNA). |
Domnívám se tedy, že pozitivní efekt acetátu, který přirozeně vzniká jako produkt střevních bakterií, jako produkt metabolizmu tuků v peroxizomech, nebo jako produkt zpracování alkoholu v játrech, je dán schopností acetylovat transkripční faktor HIF-1α a tak vymazat signál pseudohypoxie v tukové tkáni. Acetylace je navíc potřebná pro správnou činnost ovládání aktivace genů v buněčném jádru. Zachování funkční acetylace je tedy zásadní pro zdraví a pro funkční metabolizmus všech tělesných orgánů.
Doplnění
Acetylace HIF-1α, na němž závisí deaktivace pseudohypoxie, nemusí být jediným proteinem ovládajícím metabolizmus acetylací. Řada studií dokazuje, že aktivace (fosforylace) AMPK není ovládaná pouze nedostatkem ATP a nadbytkem AMP, ale již samotnou přítomností glukózy, tedy přítomnosti produktu glykolýzy zvaného fruktóza-1,6-bisfosfát (FBP), který se váže na enzym aldolázu a slouží jako senzor přítomnosti glukózy ovládající AMPK. A právě ovládání aktivity aldolázy a glycerol-3-fosfát dehydrogenázy acetylací může hrát podstatou roli v pozitivní účinnosti acetátu na metabolizmus. Jako důkaz uvedeného tvrzení nám zatím mohou sloužit dvě studie. První ukazuje, jak ovládání enzymu aldolázy mění metabolizmus a druhá ukazuje, jak acetylace aldolázy mění aktivitu aldolázy cca o tři řády.
 |
| Blokátor aldolázy aldometanib napravuje metabolizmus myší na tučné stravě. |
 |
| Acetylace blokuje činnost aldolázy. |
Zdroje:
Causes and Consequences of A Glutamine Induced Normoxic HIF1 Activity for the Tumor Metabolism
Production of acetate in the liver and its utilization in peripheral tissues
Fructose-1,6-bisphosphate and aldolase mediate glucose sensing by AMPK
The aldolase inhibitor aldometanib mimics glucose starvation to activate lysosomal AMPK









Komentáře
Okomentovat