Co je to buněčná senescence? Může stát za obezitou, kardiovaskulárními chorobami nebo i za Alzheimerem?
Pokusím se o shrnutí posledních poznatků tak, jak jsem k nim přišel z publikovaných studií, které silně podporují moji původní představu o tom, že problémy s metabolizmem nastávají, když určité množství buněk přepne z oxidačního metabolizmu na fermentační v tkáních nebo buňkách, které to normálně nedělají. Mohou to být tukové buňky nebo jaterní buňky, nebo podpůrné buňky nervového systému, ale i buňky kostní dřeně, imunitního systému apod. Velice široká škála. V tomto blogu jsem tento jev pojmenovával dosud jako pseudo-hypoxii, tedy stav, kdy buňka aktivuje mechanizmy stejné jako při nedostatku kyslíku, ale v situaci, kdy je kyslíku dostatek, při tzv. normoxii. Tento stav se také projevuje jako chronický zánět, takže řada výzkumníků považuje za příčinu zánět, aniž by věděli, co je konkrétní příčinou.
Od této chvíle budu tento stav nazývat senescencí. Proč? Protože senescence je oficiální termín pro popis buňky ve stavu, při kterém se zastavila ve svém vývoji, čeká a jen přežívá, ale neposlouchá příkaz k sebezničení, apoptóze. Čeká asi na lepší časy (opravu mírně poškozené DNA - doplněno), ale ty většinou nepřicházejí. Co je velmi, velmi důležité, senescentní buňka si to nenechává jenom pro sebe. Křičí tuto informaci na všechny strany pomocí chemických signálů. Oznamuje do celého těla a tedy všem buňkám: „Haló, já jsem tady a mám problém, může s tím někdo něco udělat?“ a tak i ostatní buňky ochotně přecházejí do tohoto stavu z preventivních důvodů a křičí stejnou zprávu, takže se zpráva zesílí a rozšíří. Ale ten signál je falešný, nic zásadního se neděje, no ale vykládejte to vystresovaným buňkám, že?
 |
| Selektivní odstranění senescentních buněk v tukové tkáni napravuje inzulinovou rezistenci. |
Jak senescencí několika buněk vzniká obezita?
Prvotním faktorem pro vznik obezity jsou změny, které proběhnou v tukové tkáni, nejpravděpodobněji kolem vnitřních orgánů, tedy viscerálního tuku. Změní se jen malé procento buněk. Změnu vyvolá přetížení některými metabolity, které by normálně vedlo k vyššímu spalování nebo ukládání, ale najednou buňka narazí na limit a víc už to nejde. Proč to víc nejde? Protože došel NADPH, protože ho nejde víc vyrobit, protože nejde víc aktivovat mitochondriální enzym IDH2 ani cytosolickou linku pro výrobu NADPH, tedy trasu PPP. Z toho důvodu nejde víc aktivovat antioxidační řetězec a navenek se to projeví vyšší produkcí peroxidu vodíku (H2O2). To je signál. Normálně se v takové situaci vytvoří víc tuku prostřednictvím de novo lipogeneze (DNL), ale ten také potřebuje NADPH. Nejde to tak, jak by bylo potřeba. Spustí se tedy obrana, senescence. Stačí přepnout jen pár buněk, a je zaděláno na obezitu. Senescenci spouští H2O2 tím, že aktivuje enzym PLA2 a z fosfolipidů buněčné membrány oddělí části arachidonové omega-6 polynenasycené mastné kyseliny a zoxiduje je na tzv. oxilipiny. Ty pak aktivují faktor PPARγ a ten spustí stav senescence. Záleží tedy na množství H2O2, složení buněčné membrány, momentální účinnosti antioxidační ochrany apod. Lze to hodně ovlivnit, například tím, co jsme historicky snědli (složení našich buněčných membrán) a co teď jíme (jaké tuky a antioxidanty). Ale pokud je buňka již přepnutá na senescenci, zpátky to nejde, nebo jen velice těžko. Nejlépe pomůže odstranění senescentních buněk apoptózou, protože jich není mnoho. Senescentní buňky ovliňují celý organizmus, způsobují inzulinovou rezistenci a metabolický syndrom.
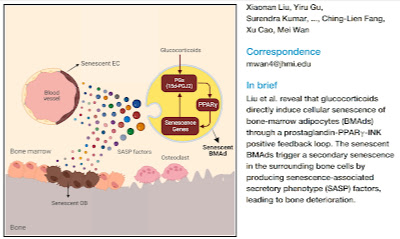 |
Glukokortikoidy aktivují senescenci tukových buněk v morku kostí, která aktivuje ztrátu kostní hmoty. |
Jak lze zabránit přetížení buněčného metabolizmu a tedy přepnutí buněk do senescence?
Existuje určitě řada možností. Jde především o to, snížit spotřebu NADPH. To lze například vypnutím de novo lipogeneze (fosforylací ACC), což umí například acetát produkovaný střevními bakteriemi, předaný játry do celého krevního řečiště k použití tam, kde je to potřeba.
Někteří výzkumníci tvrdí, že acetát se dostane do buňky snadno sám skrze membránu, já si to nemyslím. Je k tomu pravděpodobně třeba aktivovat membránový transportér MCT1, jinak by hladina acetátu musela být příliš vysoká. Aby se tedy acetát dostal do buněk, je třeba mít v krvi i laktát, který aktivuje MCT1. Tím je zajištěno, že se acetát dostane na správné místo a ve správném množství. Tam, kde probíhá bezproblémové spalování neboli oxidační fosforylace, tam je minimum laktátu, ale tam, kde se fermentuje glukóza, tam je dostatek laktátu. Právě ten pravděpodobně pomáhá vpustit acetát do buňky a zvýšit hladinu cytosolického acetyl-CoA, který vypíná pseudohypoxii (faktor HIF1A). Tak může dojít k obnovení spalování, tedy oxidační fosforylace. Toto umí acetát v kooperaci s laktátem. Konkrétně to znamená, že např. pohyb, který zvyšuje produkci laktátu, umožní lepší vstup acetátu do buněk a zlepšuje metabolismus. Podobný efekt ale bude mít např. i med nebo cukr v malém množství.
Z dlouhodobého hlediska je potřeba zajistit správné složení buněčných membrán. To je dáno zejména složením tuků ve stravě, je třeba hlavně omezit tuky omega-6, které jsou surovinou pro výrobu arachidonové kyseliny a oxilipinů. Tuky omega-3 jsou lepší, jednak aktivují produkci acetátu v tlustém střevě (ALA, lněný olej), jednak jsou v membránách podstatně lepším materiálem (DHA, EPA) než tuky omega-6, protože po jejich oddělení pomocí H2O2 vznikají jiné látky, podstatně méně toxické. V každém případě je lepší polynenasycené tuky nepoužívat jako zdroj energie, ale pouze v malém množství jako stavební materiál.
Antioxidanty, jako jsou třeba vitamíny C a E, také mohou pomoci snížit hladinu H2O2, i když na rozdíl od acetátu, jen jako prevence. Mohou snížit produkci oxilipinů snížením oxidačního stresu, ale metabolizmus napravit neumí. To umí jen krátké mastné kyseliny, zejména acetát. Např. zředěný ocet (kyselinu octovou) lze pravděpodobně použít jako doplněk stravy v koncentraci až 1% vodného roztoku podávaného průběžně během dne v malých dávkách v celkovém množství cca 0,5 litru denně, experimentálně.
Jak vzniká ateroskleróza a cévní choroby?
Jak vzniká řídnutí kostí?
Jak vzniká pravděpodobně i Alzhemerova choroba?
Vše vzniká úplně stejně. Nejprve v některém orgánu dojde k senescenci, a nemusí to asi vždy být tuková tkáň. Tím, že senescentní buňky produkují tzv. SASP faktory, rozšiřuje se senescence prostřednictvím chemických signálů do celého těla. Vlastně je senescence takový protipól rakoviny. Zastavené dělení a snížená obnova buněk, na rozdíl od rakoviny, známé překotným a nezastavitelným dělením buněk. Akumulace senescentních buněk dokonce asi může i rakovinu vyvolat. Tak se stane, že například oxidační stres vyvolaný turbulentním prouděním krve způsobí senescenci cévního endotelu, která po čase vede k ateroskleróze a cévním chorobám. Podobně senescence tukových buněk v morku kostí vede k osteoporóze.
Senescence je sice známa již delší dobu, ale není v běžném povědomí. Ne všechno je prozkoumáno, nové práce vycházejí každým dnem. Ale myslím, že je to velice dobrá stopa a povede k opravdovému řešení příčin mnoha zdravotních problémů. My navíc už víme, že senescenci lze pravděpodobně potlačit acetátem/octem. Brzy uvidíme, zda se objeví i nějaké studie na lidech. Zatím je jen málo studií, a to převážně na hlodavcích, na lidech zatím téměř nic.
Zdroje:
Targeting p21Cip1 highly expressing cells in adipose tissue alleviates insulin resistance in obesity
Inhibiting HIF-1 signaling alleviates HTRA1-induced RPE senescence in retinal degeneration
The impact of cellular senescence in human adipose tissue
Oxylipin-PPARγ-initiated adipocyte senescence propagates secondary senescence in the bone marrow
Gut bacteria identified in colorectal cancer patients promote tumourigenesis via butyrate secretion


Komentáře
Okomentovat