Může být ocet řešením Alzheimera a stařecké demence?
Ocet nebo octan nebo také acetát je velice zajímavá látka, potravinový doplněk. Pokud byste se o něm a jeho metabolizmu v těle chtěli dovědět více a do detailů, přečtěte si tento dvoudílný článek. Věnuje se pouze acetátu a má dva díly, celkem 49 hustě popsaných stran ve dvou sloupcích. To vše o molekule, která obsahuje pouze dva uhlíky. Neuvěřitelné. Má vliv zřejmě na všechny procesy v těle.
 |
| Acetát působí nejen aktivací AMPK při své přeměně na acetyl-CoA, ale i přímo na receptor FFAR2, takto například podporuje vazodilataci, tedy lepší zásobení tkání krví a kyslíkem. |
Nejprve si zopakujme základní mechanizmus, kterým acetát v těle působí proti obezitě. Je to výsledek procesů spojených s aktivací acetátu v buňce, tedy spojení s molekulou CoA na acetyl-CoA. Tato reakce spotřebovává energii (ATP) a vytváří signál nedostatku, aktivuje enzym AMPK, který omezí enzym ACC jeho fosforylací na pACC. To je asi nejdůležitější změna v souvislosti s bojem proti tloustnutí. Dalším neméně důležitým efektem je snížení tvorby laktátu v souvislosti s větším vypouštěním CO2 podpořením aktivity TCA cyklu. Jak jsem již uváděl, uhlík z jídla se buď zabuduje do tukových buněk, nebo je vydýchán jako CO2.
Právě aktivita enzymu ACC1 slouží jako přepínač mezi ukládáním uhlíku do tukové tkáně nebo vypouštěním CO2 přes plíce. Jak stárneme, více tukových buněk se přepíná z oxidačního metabolismu na fermentační, bez použití kyslíku. Může to postihnout i buňky v jiných tkáních, možná i v mozku. Fermentující buňky postupně otravují prostředí zdravým buňkám vytvářejícím energii (ATP) oxidací. Příčiny mohou být různé, nedostatečné zásobení určitých tkání krví, zpomalená činnost elektronového transportního řetězce v mitochondriích, různé otravy jedy apod.
Víme, že buňky v prostředí s vysokým obsahem tuků, by se nikdy neměly přepínat do anaerobního režimu, který nepoužívá kyslík. Tuky prostě nejdou fermentovat, to lze pouze s glukózou. Přepnutí probíhá tak, že se v buňce nahromadí sukcinát a zastaví se odbourávání transkripčního faktoru HIF-1α. V prostředí, kde se zpracovávají dlouhé mastné kyseliny vzniká nedostatek meziproduktů pro nahromadění sukcinátu, proto je hranice pro aktivaci HIF-1α daleko vyšší než v buňkách s nízkým obsahem tuků. To rozlišuje tkáně, u některých je spínání HIF-1α žádoucí, u jiných je devastující.
Nyní se vraťme k acetátu a jeho schopnosti aktivovat enzym AMPK a vypínat enzym ACC1, který tak uzavře cestu uhlíku do tvorby nových tuků. To má totiž ještě další významný efekt, zvýší se koncentrace molekul acetyl-CoA v buněčné plazmě, kde se vyskytuje i transkripční faktor HIF-1α. A tak dojde k jeho acetylaci. Zatímco acetylace v mitochondriích znamená zpomalení činnosti, acetylace v buněčné plazmě má zcela jiný význam, používá se při kontrole kvality proteinů při jejich tvorbě v organelách zvaných endoplastické retikulum (ER).
Tvorba nových proteinů probíhá tak, že se podle posloupnosti nukleotidů v RNA sestaví řetězec aminokyselin. Tato šňůra však ještě nefunguje jako enzym. Aby se sestavil nový nanostroj, který nazýváme enzym, musí být správně poskládán, to je složitý a zranitelný proces. Pokud se nepovede, nově vzniklý protein je při výstupní kontrole málo acetylován, tak se odliší od správně sestaveného proteinu, který je hodně acetylován. Při opouštění výstupní kontroly je acetylovaný správně sestavený protein deacetylován a vypuštěn. Málo acetylovaný protein je rozebrán.
Nově vytvořené enzymy nejsou acetylované. Nově vytvořený HIF-1α není acetylovaný a slouží jako tzv. obvod watchdog, tedy obvod hlídání, zda systém funguje. Pokud systém funguje, umí HIF-1α okamžitě zničit. Pokud se to nepovede, systém má problém a musí přepnout do opravného režimu, elektronický systém se obvykle restartuje. Biologický systém přepne na záložní metabolizmus, fermentaci.
Zatím se v literatuře uvádí pouze systém hydroxylace s následným odstraněním. Nalezl jsem ale studii, která ukazuje, že pro normoxii je hlavním mechanizmem acetylace s následným odbouráním HIF-1α. To je důležitá informace v souvislosti s tím, že právě zastavení aktivity ACC1 zastaví odběr acetyl-CoA a zvýší tedy acetylaci HIF-1α, zajistí jeho odbourání, a také se zajistí správná acetylace hystonů pro správné ovládání aktivace genů v buněčném jádře. Navíc zastavení tvorby tuků sníží podstatně spotřebu NADPH. V prostředí s nedostatkem glukózy a přebytkem tuků to znamená, že se může zastavit tvorba NADPH pomocí cytosolického enzymu IDH, který obrací směr mitochondriálního enzymu IDH a zastavuje TCA cyklus. TCA cyklus se tedy rozběhne ve směru hodinových ručiček a může produkovat CO2. To zajistí dostatek kyslíku výměnou za CO2. Sledujete? To je náprava oxidačního metabolizmu, oxidační fosforylace. To umí acetát/octan/ocet.
Teď opustím acetát a podíváme se na myší model Alzheimerovy choroby. Víme, že dosavadní postup léčení „Alzheimera” je zcela neúčinný a chybí vysvětlení příčin této stále častější choroby. Tato skupina vědců to vzala opačně, zkoušeli na myším modelu nejprve řadu látek a na dvou nejperspektivnějších provedli studii. Zdá se, že uspěli. Stanovili i mechanizmus, jak dvě zcela různé syntetické látky působí na mozek tak, že obnoví metabolické parametry i kognitivní schopnosti myší.
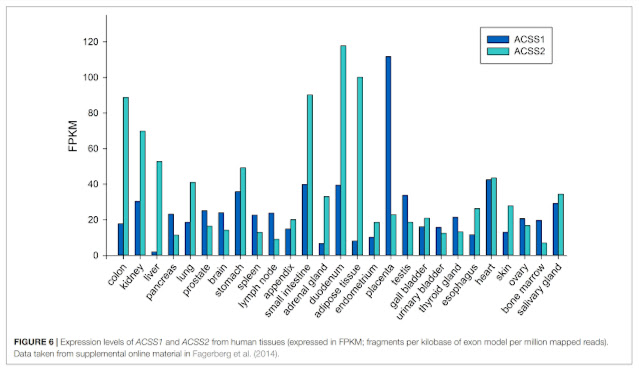
A když se podrobněji podíváte na ten mechanizmus, ouha, je to přesně ten, který jsem popsal v souvislosti s acetátem a jeho působením na tukové buňky. Že by tu byla souvislost? Působení acetátu je závislé na aktivitě enzymů ACSS2, nejaktivnější je v tukové tkáni. V mozku podle měření příliš aktivní není, ale vzhledem k tomu, že tuková tkáň vysílá do těla signalizaci, mohlo by přeprogramování tukových buněk dovolit i vzdáleným mozkovým podpůrným buňkám přejít z fermentace na oxidační fosforylaci? Je vůbec možné, že by Alzheimerova choroba měla stejnou příčinu jako obezita, tedy přepnutí části buněk z oxidační fosforylace na fermentaci, tedy aerobní glykolýzu, tedy aktivaci HIF-1α?
Podívejme se podrobněji na výsledky měření hladiny sukcinátu, aktivátoru HIF-1α. Nejprve je nízký (9mths), s postupující Alzheimerovou chorobou jeho hladina narůstá (13mths). Sledujte také rozptyl hodnot. Zatímco ostatní meziprodukty mají poměrně malý rozptyl (kromě α-ketoglutarátu, prekurzoru sukcinátu), u sukcinátu je to jinak, připomíná to směs stavů ANO/NE. My už víme, že spínání HIF-1α probíhá jako přepínač ve spojení s aktivitou enzymů NOX2.
Aktivace HIF-1α sepne produkci H2O2 pomocí NOX2, a produkce H2O2 zajistí sepnutí HIF-1α. Některé buňky tedy fermentují a zatěžují okolí oxidačním stresem z NOX2. Jiné využívají kyslík k oxidační fosforylaci, ale okolní H2O2 je ruší. Peroxid vodíku totiž oxiduje polynenasycené tuky v membránách. Jak se to projeví? Sledujte na následujícím obrázku hladinu omega-6 linolové kyseliny (Linoleyl carnitine). Proč se nám snižuje hladina linolové kyseliny s postupující demencí? Jak jsou membrány poškozovány, musí být i opravovány a doplňovány, je tedy odebírána.
Ale také vidíme nárůst linolové mastné kyseliny po aplikaci léčby (13mths+CMS121, 13mths+J147). Léčba srazila hladinu sukcinátu dolů, tedy žádná fermentace, žádná aktivace HIF-1α a NOX2, podstatně snížený oxidační stres a žádné ničení mebrán. Všechno do sebe zapadá. Stejný proces, který jsem ukázal v tukové tkáni, probíhá i v mozkové tkáni buňkám, které zajišťují výživu a podporu nervovým buňkám Demence a Alzheimerova choroba je způsobena aktivací pseudohypoxie, a my víme, že speciálně omega-6 linolová kyselina umožňuje aktivaci HIF-1α i v prostředí, kde by k němu docházet nemělo, v tukových buňkách. Nyní k tomu můžeme přiřadit i mozkové buňky.
Nenechte se mýlit, že větší doplňování polynenasycených mastných kyselin, třeba omega-3 může vyřešit problém. Pouze zajistí čerstvý materiál pro vytváření více jedů, které vzniknou poškozením membrán. Řešením je vrácení metabolického stavu zpět k oxidační fosforylaci. Už víme, že to u myší umí acetát, možná to při vhodné aplikaci bude umět i u lidí, možná umí změnit i průběh Alzheimerovy choroby a stařecké demence, kdo ví.
Acetát je také produktem metabolismu ketonů, takže efekt ketogenní diety potlačující např. dětskou epilepsii by mohl být výsledkem metabolismu acetátu. Podobně i pozitivní efekt malého množství alkoholu je s největší pravděpodobností výsledek působení acetátu. A jako poslední si můžeme uvést metabolismus alfa linolenové kyseliny (C18:3 n-3), která silně aktivuje produkci acetátu střevními bakteriemi, takže na rozdíl od dlouhých omega-3 pozitivní účinek acetátu převáží negativní účinky.
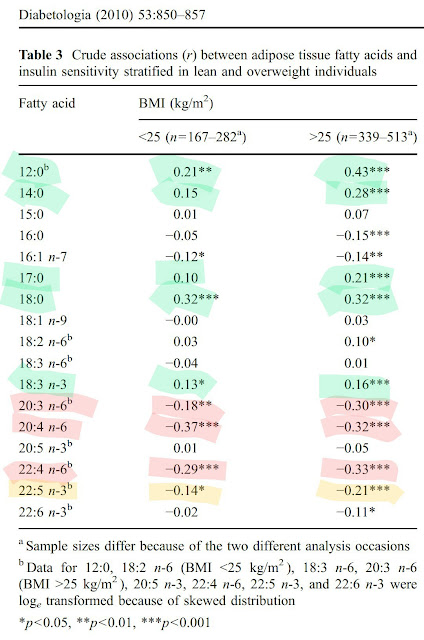 |
| Hlavní složka kokosového oleje C12:0 jako ochrana před inzulinovou rezistenci, hlavní složka olivového oleje C18:1n-9 je neutrální ale metabolické produkty linolové kyseliny omega-6 z jiných rostlinných olejů (C20:3n-6, C20:4n-6, C22:4n-6) rozhodně nepomáhají. Dokonce ani dlouhé omega-3 tuky nepomáhají. Z omega-3 má pozitivní účinek pouze ALA (C18:3 n-3), pravděpodobně pomocí acetátu produkovaného střevními bakteriemi. |
A ještě doplněk, triacetin opravdu funguje proti demenci na myším modelu.
Zdroje:
Causes and Consequences of A Glutamine Induced Normoxic HIF1 Activity for the Tumor Metabolism
Elevating acetyl-CoA levels reduces aspects of brain aging
Hypoxia compromises the mitochondrial metabolism of Alzheimer’s disease microglia via HIF1
Adipose tissue fatty acids and insulin sensitivity in elderly men
NADPH—The Forgotten Reducing Equivalent
ACSS2-dependent histone acetylation improves cognition in mouse model of Alzheimer’s disease






Komentáře
Okomentovat