Co mají společného laktát a rybí tuk? Potlačují tloustnutí! Proč?
Laktát je produkt fermentace glukózy, obvykle se má za to, že způsobuje svalovou únavu a problémy, ale asi to tak vůbec není. Rybí tuk je známý tím, že obsahuje velké množství tuků omega-3, nás bude zajímat hlavně nejdelší omega-3 tedy DHA. Co by tyto dvě látky mohly mít společného, že potlačují vznik obezity. Pozor! Rozlišujme potlačení vzniku od léčení, tedy rozlišujme prevenci vzniku obezity od zániku již existující obezity, to jsou dvě naprosto odlišné disciplíny!
Podívejme se nejprve na studii s rybím tukem, tedy s DHA. Máme zde studii na myším modelu, která obsahuje čtyři druhy tučné stravy. Kontrolní nízkotučnou (Con, 10% tuku), tučnou stravu se sádlem (HFD, 60% tuku), tučnou stravu se sádlem a světlicovým olejem (SO, 30%+30%), tučnou se sádlem a světlicovým olejem a rybím tukem (SF, 30%+15%+15%), a nakonec tučnou stravu se sádlem a rybím tukem (FO, 30%+30%).
 |
| Rybí tuk (SF, FO) působí při celoživotním užívání jako prevence proti omega-6 tukům, které vyřazují malát-aspartátový cyklus (člunek). |
 |
| Vysoká exprese IDH2 signalizuje nedostatečnou funkci, nedostatečné obnovování glutathionu, nedostatek NADPH. |
Problémy s tloustnutím se objevily pouze u skupin bez rybího tuku. Obě dvě skupiny myší s tučnou stravou s rybím tukem nevykazovaly známky obezity. Proč? Myslím, že pomocí grafů to uvidíte sami. Jde o enzym isocitrát dehydrogenázu 2 (IDH2), tedy mitochondriální enzym pro obnovu NADPH, který je součástí TCA cyklu. Zatímco množství enzymu je ve všech skupinách s tučnou stravou prakticky stejné, exprese genu, tedy požadavek na produkci proteinu, je mnohonásobně vyšší u dvou obézních skupin. Z toho vyvozuji, že u těchto dvou skupin by bylo potřeba více proteinu/enzymu IDH2, ale není k dispozici kapacita na jeho syntézu. Nedostává se tedy NADPH pro správný metabolizmus, pro obnovení hladiny hlavního buněčného antioxidantu glutathionu, to vyvolá zvýšenou produkci signálu H2O2 a buňka zareaguje obranným mechanismem, tedy nadměrnou tvorbou tuku.
Vidíme, že ne všechny tuky se chovají stejně, určité složení tuků je obezogenní. Nepatrnou změnou složení tuků lze upravit obezogenní stravu na normální, nezpůsobující obezitu. Co nám studie neříká je, že obezogenní strava provede víceméně trvalé změny v tukové tkáni a pozdější úpravy složení stravy už nebudou mít požadovaný efekt. Správné složení tuků je třeba dodržet už od útlého věku. Obezogenní strava je ta, která produkuje při spalování v mitochondriích příliš mnoho H2O2, tedy signálu přebytku paliva nebo nedostatku kyslíku. Jak už víme, spustí se adaptace na prostředí s nízkým obsahem kyslíku, pseudohypoxie, aktivuje se HIF1A v některých tukových buňkách.
Co dělá DHA tak zásadního? Aktivuje spalování tuků v peroxizomech, podporuje jejich tvorbu a snižuje zátěž mitochondrií. Výsledkem beta oxidace tuků jsou molekuly NADH a acetyl-CoA, z peroxizomů ale vystupuje laktát, malát a acetát. Je to z důvodu nepropustnosti membrán pro NADH. Pro export energie (elektronů) z peroxizomů se použijí pomocné cykly (člunky), laktátový nebo malát-aspartátový. Malát-aspartátový cyklus může obnovit NADH v cytosolu nebo může být prodloužen až do mitochondrie a tam obnovit hladinu NADH. Pro nás je důležitější obnova hladiny NADH v cytosolu, protože ta, jak uvidíme později, reguluje přísun glukózy.
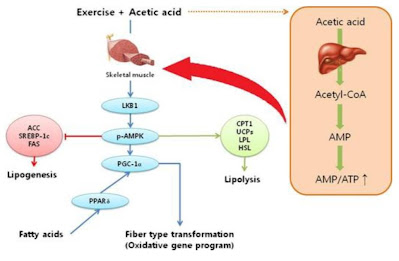
A nyní přejdeme k laktátu. Nedávno byla publikována studie, která překvapivě zjišťuje, že celoživotně doplňovaný laktát působí jako ochrana proti tloustnutí. Ukazuje se, že laktát produkovaný svaly při cvičení dokáže zabránit negativním změnám v metabolizmu myší na tučné stravě. Tak jak je to? Při normální myší nízkotučné stravě se žádný pozitivní výsledek nekoná, ale při tučné stravě prokazuje laktát ochranný účinek. Napravit již dříve poškozený metabolizmus určitě nedokáže, ale jako prevence funguje. Podobně jako aktivní pohyb a cvičení. Zajímavé. Pojďme se tedy na výsledky podívat podrobněji, zkusíme najít mechanizmus.
 |
| Celoživotně doplňovaný laktát působí proti obezitě způsobené některými tuky (omega-6) |
Řízení procesů, které probíhají po sobě (v sérii) není jednoduchá záležitost. Pan Ford kdysi vymyslel systém běžícího pásu, aby se mu nekupili nedokončené výrobky na mezioperacích. Příroda žádný běžící pás použít nemůže, proto musí regulovat samostatně každý proces a ještě přes jeden nebo dva procesy. Takový systém je obtížné vyladit a jakékoliv porušení jedné regulace vyvolá změny ve všech regulačních smyčkách. Pojďme se vrátit ke schématu glykolýzy. Tentokrát zcela pomineme regulaci přes inzulin a AKT, protože to je podle mne vyšší regulace, která jen odráží poškozenou regulaci nižších stupňů.
Pokud máme hledat jádro problému s tučnou stravou myší, já to vidím takto. Víme, že z nějakého důvodu, který nás teď nezajímá, je vyšší aktivita de novo lipogeneze (DNL), tedy je více aktivní enzym ACC a jím vytvořený malonyl-CoA o trochu více brání vstupu dlouhých mastných kyselin do mitochondrií ke spálení. Prostě se spaluje méně tuků než odpovídá složení stravy. Muselo tedy dojít k trochu menší aktivaci AMPK, a to je způsobeno trochu vyšší hladinou fruktóza-1,6-bisfosfátu (Fru1,6BP). Fru1,6BP se ukazuje jako zásadní pro detekci dostatku glukózy v buňce a pro regulaci vstupu glukózy do buňky, resp. její fosforylaci na glukóza-6-fosfát (Glc6P).
Takže otázka zní, jak je regulována hladina Fru1,6BP? Je to molekula, která je uprostřed procesu. Její hladina je dána aktivitou vstupních a výstupních enzymů. Vstupní enzymy jsou řízeny hladinou Fru1,6BP v záporné zpětné vazbě, hladina je tedy stabilizovaná. Odběr molekul je dán aktivitou enzymu GAPDH, jeho funkce se zdá být klíčová. Vyšší hladina Fru1,6BP by tedy mohla být projevem nízké aktivity GAPDH.
 |
| Tučná obezogenní strava (HFD) potlačuje aktivitu GAPDH více, než odpovídá hladině NADH (pravděpodobně vysokou produkcí H2O2). |
Hlavním regulátorem aktivity GAPDH bude, jako u všech podobných enzymů, hladina produkovaného kofaktoru, tedy NADH. Nízká hladina NADH zvýší aktivitu GAPDH a umožní doplnit více glukózy. Vysoká hladina NADH bude působit opačně. Pokud se spaluje pouze glukóza, hladina NADH je nižší, aktivita GAPDH vyšší, Fru1,6BP je odebírán masivně pro další zpracování a fosforylace glukózy probíhá na vstupu normálně.
Při spalování glukózy s tukem se zvýší hladina NADH a vstup glukózy bude přes GAPDH a vyšší hladinu Fru1,6BP "přiškrcen" tak, aby se vše dobře doplňovalo. Kritériem pro správnou činnost regulace je obvykle nízká mitochondriální produkce H2O2 při oxidační fosforylaci. Pokud mitochondrii přetížíme, oznámí nám to zvýšenou produkcí H2O2 a buňka na to musí reagovat. Vhodnou reakcí je třeba zvýšení zásobení kyslíkem, další vhodnou reakcí je aktivace mitochondriálního rozpojení nebo snížení množství paliva. Už víme, že pokud buňka včas nezareaguje, překlopí se metabolizmus na fermentační. Aktivuje se HIF1A. To vyvolá aktivaci imunitního systému a aktivaci enzymů NOX2, které produkují zase H2O2 a snaží se buňku vypnout apoptózou. Často místo toho dojde pouze ke snížení aktivity enzymu GAPDH a zvýšení hladiny Fru1,6BP, snížení AMPK, zvýšení ACC a k navýšení de novo lipogeneze a omezení spalování tuků. Pokud nedojde k deaktivaci HIF1A acetylací, je tento stav pro tukovou buňku trvalý.
Nemůžu si pomoci, hlavním regulátorem vstupu glukózy do buňky je cytosolická hladina NADH. Pokud se mitochondriální hladina NADH přestane kopírovat do cytosolické prostřednictvím malát-aspartátového cyklu, regulace přísunu glukózy přestane fungovat. Procesy, které snižují hladinu NADH nesmějí překročit určité meze, tedy například ani spotřeba NADPH. Používá se na obnovu hlavního buněčného antioxidantu glutathionu (GSH). Jsou tuky, které spotřebovávají více GSH než jiné tuky. Dokonce jsou tuky, které při beta oxidaci spotřebovávají přímo NADPH (omega-6). Při tučné stravě výroba NADPH spotřebovává NADH nebo omezuje výrobu NADH v mitochondrii. Vyšší spotřeba NADPH se tedy projeví snížením hladiny NADH. Toto snížení se přenese do cytosolu a i tam dojde ke snížení NADH, zřejmě proto, aby se doplnila glukóza, ze které se vyrábí NADPH pomocí trasy PPP. Jenže kapacita výroby NADPH z glukózy nestačí pro spalování tuků, zejména polynenasycených tuků s dvojnými vazbami na sudých pozicích. Buňka chce víc NADPH, vpustí víc glukózy, ale cesta PPP k NADPH je již saturována, glukóza se tedy dostane až do mitochondrie, doplní hladinu NADH ale dojde k přetížení antioxidačního systému a ke zvýšení hladiny H2O2. Reakcí buňky je buď krátkodobé omezení GAPDH s aktivací DNL, nebo dlouhodobé omezení hlavního vstupu pyruvátu do mitochondrie, enzymu PDHC prostřednictvím aktivace HIF1A (v tukových buňkách). Oba způsoby rozpojí vazbu mezi mitochondriální a cytosolickou hladinou NADH tím, že spadne hladina aspartátu i malátu, tedy rozpojí se aspartát-malátový cyklus. K tomu, aby se obnovily hladiny aspartátu a malátu je třeba z pyruvátu pomocí mitochondriálního enzymu PC vytvořit oxaloacetát, který doplní aspartát-malátový cyklus o potřebné molekuly. Vstup pyruvátu do mitochondrie je ale zablokován (PDK aktivovaný pomocí HIF1) nebo se vůbec pyruvát netvoří (blokace GAPDH pomocí H2O2). V případě aktivace HIF1 je nastartována tvorba laktátu pomocí LDH, jedná se o záchranný fermentační metabolismus, pseudohypoxii.
Jak nám tedy může pomoci laktát, abychom se do tohoto stavu nedostali?
Laktát dostupný z metabolizmu ostatních buněk nebo doplňovaný externě zpomalí nebo otočí činnost LDH směrem k tvorbě NADH a pyruvátu. Pomůže tedy udržovat v chodu aspartát-malátový cyklus a udržet tak hladinu cytosolického NADH i při spalování problematických tuků, které spotřebovávají hodně NADPH. To je důležité, protože zůstane zachována regulační schopnost GAPDH a nedojde k rozpojení aspartát-malátového cyklu nedostatkem pyruvátu a k následné aktivaci HIF1A v některých tukových buňkách, které pak spustí trvalé tloustnutí.
Vraťme se ještě k DHA a rybímu tuku. Pokud víme, že DHA aktivuje a rozmnožuje peroxisomy a pokud víme, že výstupem beta oxidace tuků v nich je malát a laktát, mechanismus je stejný jako při doplňování externího laktátu. Jen je k tomu potřeba pyruvát nebo oxaloacetát z mitochondrií. Jako prevence to funguje, ale deaktivovat již aktivovaný signál HIF1A v tukových buňkách DHA neumí. Naopak může být v silně oxidačním prostředí (NOX2) degradován na toxické produkty auto oxidace. Rybí tuk ani DHA nejsou vhodné jako doplněk stravy při již existujících metabolických problémech. Nejprve je třeba vypnout HIF1A a NOX2!
A zase jeden dodatek.
Trochu jsem přehlédl ve studii s laktátem i část, která nejprve 8 týdnů vykrmovala myši tučnou stravou a potom se je snažila zhubnout intenzivním cvičením a nebo intenzivním cvičením doplněným injekcí laktátu. A podařilo se jim to. Tato část studie totiž představuje model léčení, nikoli pouze prevence. To mne trochu znejistělo, výše upozorňuji, že léčení a prevence jsou dvě různé disciplíny a dosud jediná látka/látky, které opravdu léčí obezitu, jsou krátké mastné kyseliny, nejčastěji acetát. O žádné další takové látce nevím. Z tohoto úhlu pohledu bychom tedy měli každou úspěšnou studii na hubnutí posuzovat, jestli to nějakým způsobem nemohl provést acetát. Bohužel žádná studie na obezitu a hubnutí nikdy neměří ani hladiny ani toky acetátu. Nikdy! Je to snad záměr?
Otázka tedy zní, mohly by výše uvedené studie být úspěšné v zabránění obezity právě díky účinkům acetátu? Mohly se nějak změnit toky a hladiny acetátu? A odpověď zní: Ano. Mohl to způsobit acetát.
U první studie s rybím tukem by to mohla být zvýšená jaterní produkce acetátu při aktivací peroxizomů, navíc spojená s produkcí laktátu, jehož efekt zmíním dále.
Laktát jako takový by měl situaci zhoršovat. Pokud máme myši na stravě složené převážně z cukru (cca 10%cal) a sádla (60%cal), pak střevní bakterie produkují dostatek endotoxinu LPS. Tuky mají nepříjemnou vlastnost tyto endotoxiny dostat do vnitřního oběhu, do těla. Tyto endotoxiny se pak váží na receptory TLR4 a způsobují záněty. Nás zajímá hlavně zánět v tukové tkáni. V tomto blogu většinou píši o tzv. pseudohypoxii, tedy aktivaci HIF1A =HIF-1α a aktivaci enzymu NOX2, což je ve výsledku to samé jako zánět. Pseudohypoxická buňka zavolá imunitní systém a výsledkem je zánět, který ale není aktivován TLR4 receptory. Zda je příčinou aktivace TLR4 nebo HIF1A nelze snadno rozlišit, protože spouštějí jeden druhého i naopak. A laktát by měl zvyšovat aktivitu TLR4, tedy měl by situaci zhoršovat. Proč ji zlepšuje?
Tady si musím položit otázku, nemůže i u laktátu hrát hlavní roli acetát? Může! Laktát aktivuje membránové transportéry MCT1, zvětšuje jejich počet v buněčné membráně, Tyto transportéry umí velice dobře přenášet nejen laktát, ale i acetát. Nemám na to data, ale in vivo, tedy na živém modelu, se hladina acetátu v buňce může významně měnit. To může ovlivnit acetylaci HIF1A a vypnout pseudohypoxii a zánět. Nevím, jakým způsobem by to mohl provést laktát jinak než prostřednictvím acetátu. Samotné navýšení hladiny NADH nebo pyruvátu na vypnutí HIF1A a NOX2 určitě nestačí.
Acetát možná funguje jen v přítomnosti extracelulárního laktátu. To by znamenalo, že právě hypoxické buňky po ukončení hypoxie budou i největšími příjemci acetátu. Aby byl acetát účinný jako terapie, možná by bylo potřeba zvýšit i hladinu laktátu. To se dá poměrně snadno provést fruktózou např. medem nebo ovocem. Nebo třeba cvičením, nebo také červeným světlem. Nebo pomalým dýcháním nosem.
Reference:
Docosahexaenoic acid mediates peroxisomal elongation, a prerequisite for peroxisome division
Kinetic modeling of glucose central metabolism in hepatocytes and hepatoma cells
Fructose-1,6-bisphosphate and aldolase mediate glucose sensing by AMPK
Mechanism of GAPDH Redox Signaling by H2O2 Activation of a Two−Cysteine Switch






Komentáře
Okomentovat