Co je to mitochondriální rozpojení, a je to dobré nebo špatné?
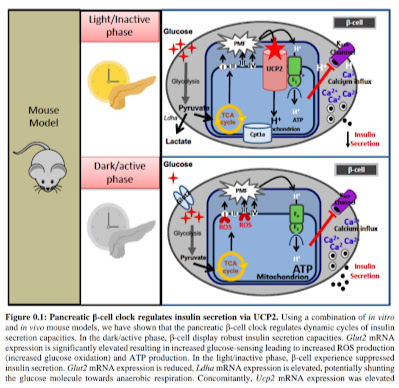
Když si mitochondrii přestavíme jako parní elektrárnu s parním kotlem a generátorem, pak mitochondriální rozpojení bychom si mohli přirovnat k přetlakovému pojistnému ventilu na parním kotli. Pokud spotřebováváme hodně elektrické energie, vše běží jak má. Pokud ale nepotřebujeme elektrickou energii, musíme snížit přísun energie do generátoru. Tlak uvnitř parního kotle tak začne stoupat a my musíme nějakou tu páru vypustit pryč, aby nám kotel nebouchnul. V mitochondrii je elektrickým generátorem komplex V a parním kotlem vnitřní mitochondriální membrána, kde se vytváří a udržuje elektrické napětí pomocí komplexů I až IV. K vybíjení napětí dochází právě na komplexu V, kde se tvoří molekuly ATP. Proteiny mitochondriálního rozpojení (uncoupliíng, UCP) zajišťují řízené vybíjení napětí tak, aby nedošlo k poškození mitochondrie.
Tyto proteiny/enzymy jsou dva, UCP1 a UCP2. Nás bude zajímat UCP2, protože ten je prakticky v každé tkáni, v každé buňce, v každé mitochondrii. UCP1 je aktivní pouze v hnědé tukové tkáni, která slouží jako naše kamínka, zahřívá nás, ale je jí v těle hodně málo. Protein UCP2 umí také zahřívat jako UCP1, ale mnohem méně a jeho účinek je tedy hlavně jako ochrana mitochondrií před přetížením. Pokud se blíží přetížení, mitochondrie produkuje více superoxidu (O2-) a peroxidu vodíku (H2O2). To aktivuje tvorbu proteinu UCP2 a ten pak vybíjí elektrické napětí tak, že umožní části protonů projít membránou, vytváří tedy elektrický vybíjecí odpor, svod. Rozpojuje se tak vazba mezi oxidací paliva a tvorbou ATP. Pro stejné množství ATP je pak potřeba více paliva a více kyslíku. Nebo pří stejné oxidaci paliva dochází k výrobě méně ATP a zbytek je tepelná energie. Enzymy UCP snižují účinnost procesů tvorby ATP a tak tyto procesy od sebe částečně oddělují, proto se tomu říká rozpojení (anglicky uncoupling).
 |
| Protein UCP1 je aktivní pouze v hnědé tukové tkáni, UCP2 je aktivní po celém těle. Nejdůležitější je ale asi jeho aktivita v pankreatu, kde ovlivňuje produkci inzulínu. |
Protein UCP2 se aktivuje v situaci, kdy je třeba vypustit páru, tedy vždy, když vzniká příliš velké napětí na vnitřní mitochondriální membráně. Je to zařízeno tak, že přebytečné energetické elektrony z jídla se zachytí na kyslíku a vytvoří molekuly superoxidu O2- který je ihned přeměněn na peroxid vodíku H2O2 enzymem superoxid dismutázou (SOD). K tomu je dobré statické geomagnetické pole, jak jsem již psal zde. Peroxid vodíku uvolní mastné kyseliny z membrány a UCP2 je použije ke své činnosti a tak nižuje napětí na membráně. To se nejvíce projeví v beta buňkách slinivky břišní, které vyrábějí inzulín.
Inzulín je velmi zajímavý hormon. Ovládá celé tělo, vlastně je to takový „dálkový komunikační signál o hladině peroxidu“. Beta buňky sledují hladinu glukózy v krvi a vyrábějí v mitochondriích molekuly ATP z glukózy a tuků. Čím více glukózy, tím více ATP a tím více inzulínu se vypustí ven z beta buňky. Při tom v mitochondriích vzniká také superoxid a H2O2, tato informace se přenáší do celého těla inzulínem. Pokud ho vzniká moc, aktivuje se přetlakový ventil UCP2 a sníží se napětí i produkce ATP a inzulínu, ale pouze v beta buňkách. V tukové tkáni ne. To znamená, že tuková buňka dále bude zásobovat beta buňky volnými mastnými kyselinami a bude v nich ještě více aktivovat UCP2.
Je to obrana. Pokud je produkce H2O2 v běžných mezích, inzulín informuje celé tělo, říká buňkám zvyšte aktivitu a tím i produkci H2O2. Tím se glukóza z krve přenese do všech buněk a zpracuje se, obvykle ve svalech a játrech na glykogen. Peroxid vodíku je také hlavním aktivátorem ukládání tuků do tukové tkáně. To vše sdělují beta buňky celému tělu a navíc získávají zpětnou informaci prostřednictvím hladiny volných mastných kyselin. Ty při nízkých hladinách také aktivují produkci inzulínu a řízeně stabilizují hladinu inzulínu a volných mastných kyselin, vysílač se sladí s přijímačem tak, aby produkce H2O2 byla optimální. Při vyšších hladinách se ale UCP2 rozejde, v tukové tkáni nebude aktivován a v beta buňkách bude silně aktivován.
Pokud tedy dojde ke zvýšení hladiny volných mastných kyselin (FFA), nebo se nám do tohoto systému přenosu informace inzulínem vmísí nějaký narušitel, informace bude zkreslena, nepředá se správně. Jakého narušitele mám na mysli? Další zdroj peroxidu vodíku.
Už jsme se zde setkali s tím, že příliš vysoká produkce H2O2 může některé buňky přepnout do anaerobního režimu, aktivuje se v nich transkripční faktor HIF-1α a ten pak aktivuje enzym NADPH oxidázu NOX2. To je velký a trvalý zdroj peroxidů. Nebo linolová kyselina, prodloužená na arachidonovou kyselinu a umístěná v membráně jako fosfolipid, může spustit řetězec reakcí který aktivuje xanthine oxidázu, to je další obrovský a trvalý zdroj H2O2. Určitě je ještě daleko víc parazitních zdrojů peroxidu.
Dalším prvkem systému komunikace jsou játra. Zdánlivě do tohoto systému nemají co mluvit, ale opak je pravdou. Ovlivňují zpětný přenos informací pomocí FFA. Játra jednak sbírají FFA do balíčků VLDL, tak se nedostanou do beta buněk, navíc umí v peroxizomech zpracovat FFA na acetát, a ten se naopak dostane do beta buněk a zvyšuje produkci inzulínu přes receptory GPR41/GPR43. Zatímco stimulace přes receptory GPR40 je alespoň částečně prozkoumaná, acetát prozkoumaný není, škoda. Acetát se totiž zdá být klíčový pro opravu rozpadlé inzulínové komunikace.
 |
| Zvýšená produkce H2O2 vede k aktivaci všech tras potřebných k ukládání tuků a tloustnutí (WG). |
 |
| Odstranění zdroje H2O2 (12/15-LOX-- + HFD) zabrání vzniku obezity. |
A nyní záleží na tom, jestli ten falešný zdroj H2O2 je na straně vysílací, tedy na straně překladu signálu H2O2 na inzulín, nebo na druhém konci, na straně přijímací, na straně překladu signálu inzulínu na signál H2O2. Na obou stranách dojde k ovlivnění, ale na každé straně jinak. Na straně přijímací bude obvykle falešný signál chápán jako příkaz k ukládání tuků, jako signál nedostatku kyslíku pro oxidační fosforylaci. Pokud se ale podaří aktivovat UCP2 a AMPK, pak se bude aktivovat produkce tepla místo tuků.
Na straně vysílací je to složitější, například trvale zvýšená hladina glukózy aktivuje UCP2 tak ûčinně, že dojde ke zvýšené produkci inzulínu už při nízké hladině glukózy, ale vůbec nedojde k dalšímu zvýšení, signál je blokován. Lze ho zvýšit jediné přidáním signálu H2O2 přímo dodáním peroxidu. Ten uvolní z fosfolipidů mitochondriální membrány volné mastné kyseliny a ty aktivují paralelní cestu uvolnění inzulínu.
Tento proces zaujal některé vědce natolik, že navrhují postup zvýšení produkce inzulínu pomocí deaktivace ochrany UCP2. No nevím zdá se mi to poněkud riskantní, sice se normalizuje produkce inzulínu ale dlouhodobě pravděpodobně za cenu zničení mitochondrií. To opět sníží produkci inzulínu, možná už nevratně. Ale u myší na tučné stravě to funguje, viz obrázek. Myši nemají ani zánět ani nejsou obézní, zajímavé.
 |
| Genetická deaktivace UCP2 (UCP2 KO) zabrání obezitě myší na tučné stravě (HFD). |
Proces řízení uvolňování inzulínu z beta buněk je opravdu závislý na mnoha parametrech. Má minimálně tři složky, které pracují vedle sebe - GSIS, RSIS a FASIS + GPR (stimulace glukózou, H2O2 a tuky + tukovými GPR receptory). Co je zajímavé, vypnutí UCP2 v tučném prostředí působí opačně než pouze při stimulaci glukózou. U glukózy vypnutí UCP2 vede ke zvýšení sekrece inzulínu, v přítomnosti palmitové kyseliny ale dojde vypnutím UCP2 ke snížení produkce inzulínu. To by mohlo stát i za účinností vypnutí UCP2 proti obezitě myší. Kdo ví?
Nevím, jestli se dá z těchto studií udělat jednoznačný závěr. Já bych se držel toho, že inzulínový informační systém celého těla je funkční pouze pokud není rušen falešnými zdroji H2O2, to mne vrací k tomu, že musíme zabránit spínání HIF-1α v tukové tkáni a také musíme zabránit aktivaci xanthine oxidázy (XO) produkty metabolizmu linolové kyseliny. Snažte se tedy omezit příjem omega-6 na minimum a dobře dýchejte, pomalu, abyste zadrželi co nejvíce CO2 v těle a zajistili tak dobré předávání kyslíku tkáním. Kyslík cirkulující neustále v krvi je tkáním k ničemu.
Zdroje:
Investigating the metabolic and molecular regulators of diurnal insulin secretion
A role for uncoupling protein‐2 as a regulator of mitochondrial hydrogen peroxide generation
UCP2 KO mice exhibit ameliorated obesity and inflammation induced by high-fat diet feeding




Komentáře
Okomentovat