Laktát pomocí hořčíku vypíná oxidaci glukózy.
Už jsem zde mnohokrát probíral, že za hlavní problém související s civilizačními chorobami považuji potlačený energetický metabolismus buněk. Ty prostě z nějakého důvodu, a může jich být mnoho, provozují úsporné mechanismy a šetří, kde se dá. Tak postupně potlačují spotřebu saturovaných tuků a glukózy a ukládají je jako tuky. Zbývá potom pouze málo možností, jak probudit energetické mechanismy a zvýšit rychlost metabolismu.
Pokud pomocí nenasycených tuků zapneme peroxizomy, omezíme vstup nasycených tuků do mitochondrie (pomocí malonyl-CoA), omezí se v nich i spalování sacharidů (pomocí fosforylace PDH komplexu). Pro zpracování paliva nám tedy zbudou pouze peroxizomy zpracovávající nenasycené tuky na acetát, a dále dikarboxylové kyseliny, které ve výsledku produkují sukcinát. Přitom bude v peroxizomech konvertován pyruvát na laktát. Ale glukóza bude v tomto konkurovat, nebude oxidována ale bude fermentována také převodem pyruvátu na laktát. Oba procesy si konkurují a záleží pouze na poměru NADH/NAD+, při přebytku NADH zvítězí fermentace glukózy, takže i spalování nenasycených tuků v peroxizomech bude nakonec potlačeno, protože způsobuje přebytek NADH. V této situaci se buňka buď zachrání aktivací HIF-1 (což podporuje např.. fruktóza), nebo provede apoptózu, tedy buněčnou recyklaci, rozebere se (bez fruktózy). Některé buňky by se neměly zachraňovat, např. tukové buňky. Ty, pokud nefungují správně, dokáží poškodit celý organizmus. Vypnutí HIF-1α v tukových buňkách tomu zabrání.
Jaké palivo by dokázalo tato uzavřená vstupní vrátka do mitochondrií přeskočit nebo obejít? Už víme o MCT oleji. Střední a krátké řetězce nejsou blokovány, to platí i pro sukcinát jako produkt zpracování dikarboxylových mastných kyselin vytvořených v buňce omega oxidací tuků.
Nebo by mohlo jít prošťouchnout cestu glukóze (defosforylovat PDH komplex) pomocí inzulinu. Asi to jde, např. pomocí akutního oxidačního stresu (cvičením) nebo jednorázovou dávkou většího množství sacharidů bez fruktózy /cukru), jak uvádí Brad Marschall. Takto asi funguje i rýžová dieta Dr. Kempnera, o které jsem se již zmiňoval.
Co je průvodním znakem metabolických problémů? Zvýšená produkce laktátu. Už jsem ho tu zmiňoval jako meziprodukt, který organismus používá v případě, že nějaký orgán nebo buňka nemůže zpracovat glukózu oxidací až na oxid uhličitý, třeba z důvodu nedostatku kyslíku. Buňka v takovém případě provádí fermentaci. Poznali jsme také, že zvýšená hladina laktátu je i důležitým signálem, který přeprogramovává metabolismus buňky, otvírá laktátové transportéry MCT4 prostřednictvím aktivace signálu indikujícího hypoxii (HIF-1).
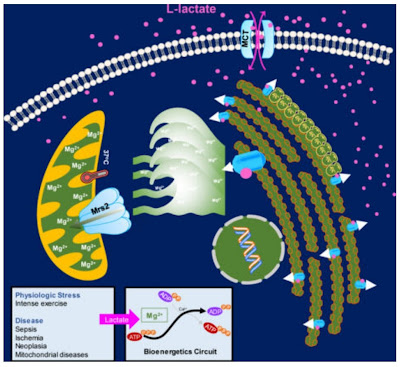 |
| Laktát uvolní ionty Mg2+, které vstoupí do mitochondrií pomocí transportérů Mrs2 a tak potlačí oxidaci glukózy. |
Nedávno se objevily studie, které objasňují důležitou část této signalizace. Ukazuje se, že laktát přímo aktivuje fosforylaci PDH komplexu prostřednictvím iontů hořčíku Mg2+. To znamená že laktát potlačuje spalování glukózy v mitochondriích. To podpoří nasměrování glukózy k další fermentaci a vyšší produkci laktátu, je to tedy kladná zpětná vazba (spínač). Jakmile buňka začne produkovat laktát, ať už z jakéhokoliv důvodu, přepne se a potlačí oxidační fosforylaci, považuje ji za nefunkční a podle toho se přeprogramuje na metabolismus, ke kterému nepotřebuje kyslík.
A důležitou součástí této signalizace je hořčík uvolněný z organely zvané endoplazmatické retikulum. Čím víc hořčíku se při stimulaci laktátem uvolní, tím víc ho přijme mitochondrie a v ní budou potlačeny procesy závislé na vápníku, hlavně regulační enzym pro zpracování glukózy, který převádí pyruvát na acetyl-CoA, tedy komplex pyruvát dehydrogenázy (PDH komplex). Hořčík a vápník zde působí proti sobě, vápník aktivuje defosforylaci PDH, hořčík podpoří fosforylaci a tím deaktivaci PDH komplexu.
Je třeba se pokud možno vyhýbat potravinám a jedům, které produkci laktátu v buňce vyvolají. Mezi nejvíce problematické jedy patří produkty samovolné oxidace stolních olejů ze semínek. Dalším zdrojem jedů je náš trávicí systém, konkrétně tzv. lipopolysacharidy (LPS), které se zde tvoří činností a hlavně rozpadem bakterií. Neporušenost a zdraví střevní stěny rozhoduje o tom, kolik těchto jedů pronikne do krve a tak do dalších orgánů. Samozřejmě také nemoc, kdy odumřelé bakterie aktivují tvorbu laktátu a tak spouští imunitní reakci organismu, nebo i nedostatek kyslíku a špatné dýchání (hyperventilace) může podpořit tvorbu laktátu.
Na druhé straně látky, které provádí tzv. chelaci iontů hořčíku v cytosolu, by mohly pracovat proti laktátu. Také vypnutí transportérů pro vstup hořčíku do mitochondrie kompletně potlačí zpomalení metabolismu a vznik obezity u myší krmených tučnou stravou. Možná by se tímto mechanismem dal vysvětlit i ochranný efekt azelaové kyseliny při tučné stravě myší. Podobný efekt by mohl mít i sukcinát nebo malát. Pokud se omezí množství volného hořčíku tím, že jsou ionty hořčíku vázány v komplexech s dikarboxylovými kyselinami, nemohou se dostat do mitochondrií a nemohou tak deaktivovat procesy závislé na vápníku. Azelaové komplexy s hořčíkem (aza) jsou pravděpodobně mnohem stabilnější než s vápníkem. Uvidíme, co přinese další výzkum.
Zdroje:
Lactate Elicits ER-Mitochondrial Mg2+ Dynamics to Integrate Cellular Metabolism



Komentáře
Okomentovat