Voda, sůl a polyolová dráha, AR jako škůdce nebo ochránce?
V jednom starším příspěvku jsem stručně informoval o práci Dr. Ricka Johnsona týkající se účinků fruktózy, kde zmínil i efekt vysoké koncentrace soli nebo problémy při omezení příjmu vody. Obojí vytváří osmotický stres, který se projeví aktivací polyolové dráhy. Pojďme pátrat po mechanizmu, který nám může napovědět i nějaké cesty ke zlepšení, nebo návod k tomu, čeho se vyvarovat.
Zkusíme nejprve zjistit, co udělá vypnutí tvorby enzymu KHK, který fosforyluje (aktivuje) fruktózu. Na případu myší jsme viděli, že vyloučení aktivace KHK (KHK KO) vede k silnému potlačení vlivu endogenní fruktózy (vytvořené v játrech z glukózy) i dietní fruktózy. Co tedy provede omezení příjmu vody? Aktivuje polyolovou dráhu? Zabrání tomu vypnutí KHK?
 |
Vypnutí metabolizmu fruktózy (KHK-KO) nemá žádný efekt na hladinu fruktózy v hypothalamu při nedostatku vody (WR). Může za to dietní fruktóza? |
Ano, nedostatek vody (WR) aktivuje endogenní tvorbu fruktózy. Ale nepřítomnost enzymu KHK vypíná endogenní produkci fruktózy. Pro vyslovení nějakých hypotéz musíme nejprve zjistit, zda strava obsahovala fruktózu. Nevím, autoři to nezmiňují. Restrikce vody prostě zvýšila koncentraci fruktózy u obou skupin.
 |
| Vypnutí metabolizmu fruktózy (KHK-KO) nemá žádný efekt na osmotický stres. |
Neměl by tam být vlastně žádný rozdíl, koncentrace fruktózy i osmotický stres jsou prakticky stejné u kontrolní (WT) a geneticky upravené (KHK-KO) skupiny. Ale vypnutí KHK přece jen něco změní, neaktivuje se dráha AMPD2 -> XO -> urát. Potlačí činnost xantin oxidázy (XO), největšího producenta H2O2.
 |
| Vypnutí metabolizmu fruktózy (KHK-KO) potlačuje tvorbu kyseliny močové z AMP/IMP, potlačuje aktivitu xantin oxidázy, největšího producenta H2O2. |
Nabízí se myšlenka, zda zvýšená hladina fruktózy nemůže zastavit polyolovou dráhu. Ano, tato dráha opravdu neprodukuje ani sorbitol ani fruktózu při vypnutém metabolizmu fruktózy. Ale nepřítomnost sorbitolu znamená, že omezení aktivity prvního enzymu polyolové dráhy (AR) není pravděpodobně způsobeno přímým účinkem fruktózy, ale něčím jiným. Čím?
 |
| Vypnutí metabolizmu fruktózy (KHK-KO) potlačuje expresi prvního enzymu polyolové dráhy, aldózovou reduktázu (AR), jejimž produktem je sorbitol. |
 |
| Vypnutí metabolizmu fruktózy (KHK-KO) potlačuje expresi prvního enzymu polyolové dráhy, aldózovou reduktázu (AR). |
Musí existovat nějaká možnost vypnout aldozóvou reduktázu (AR). Podívejte se, vůbec se nezvýšila při osmotickém stresu při nedostatku vody, pokud byl deaktivován metabolizmus fruktózy.
Dietní fruktózu dokážeme snadno snížit například nahrazením cukru glukózou nebo vynecháním cukru. Ale vypnutím AR bychom mohli snížit i endogenní produkci fruktózy, ta je pravděpodobně mnohem nebezpečnější. Hlavně pokud je spojena s konzumací dlouhých mastných kyselin v tucích. Ty usnadňují aktivaci polyolové dráhy se všemi důsledky, zejména se aktivuje ukládání tuků. Pokud se polyolová dráha neaktivuje, nebude potřeba ani enzym KHK, protože bez dietní fruktózy nikde žádná fruktóza nebude. To umožní normální činnost enzymů pro spalování glukózy i tuků. Nebudou acetylované, protože bude zachována činnost deacetyláz SIRT1, SIRT2 atd.
Měli bychom zjistit, jak se to stalo, že polyolová dráha byla potlačena u KHK-KO. Co způsobilo zastavení AR. Lze zastavením dráhy AMPD2 -> XO -> urát zastavit i AR? Nebo to způsobila přímo zvýšená hladina fruktózy? Nebo je potřeba osmotický stres?
Mechanizmus jsem zatím nenašel, budeme pátrat. Můžeme se podívat, co udělá osmotický stres s buňkami ve zkumavce. Osmotický stres aktivuje transkripční faktor NFAT5 a ten přímo aktivuje produkci enzymu AR. Zde vidíme aktivaci glukózou (G) a roztokem chloridu sodného, tedy kuchyňskou solí (N) ve zkumavce. (M) ponecháme stranou. Velmi záleží na koncentraci a čase působení.
Vidíme paradoxní situaci, kdy aktivace SIRT1 pomáhá aktivovat AR, tedy polyolovou dráhu. Osmotický stres vyvolaný chloridem sodným se projevuje aktivací NFAT5, a tedy i AR, až po cca 16 hodin trvajícím stresu. V aktivaci pomáhá i SIRT1, který se ale aktivuje až při dlouhodobém stresu. Vypadá to že pokud osmotický stres netrvá příliš dlouho, polyolová dráha se nespustí.
Polyolová dráha musí být k něčemu velmi užitečná. Dá se najít, že aktivace tvorby sorbitolu v ledvinách chrání buňky před účinky kyseliny močové, před urátem. Aktivace deacetylázy SIRT1 zde může pomáhat. Ale v játrech bych raději polyolovou dráhu nezapínal, nebo i tam může být užitečná?
Víme, že acetát/octan potlačuje účinky fruktózy nejspíše aktivací SIRT1, bojuje tak proti deaktivaci SIRT2 fruktózou. Ale je to stejně nějaké divné.
Jakou roli v tom hraje urát zatím nedokážu popsat. Vypnutí AMPD2 vede u myší k zvýšení hladin tuků a cholesterolu v krvi, přestože zůstávají štíhlé a netloustnou. Je potlačeno spalování i ukládání tuků v těle, ale vede to je ztučnění jater. Je omezen vstup tuků do mitochondrií. Je to zřejmě ten správný stav pro udržení metabolizmu v chladném prostředí při zimním spánku zvířat. Aktivita AMPD2 je silně závislá na teplotě a při prochladnutí je téměř nulová. To umožní zachovat aktivitu AMPK a spalovat pomalu tukové zásoby.
Pro běžný aktivní život tedy vypnutí AMPD2 nevede k nápravě metabolizmu, zřejmě nějakou optimální regulovanou hladinu kyseliny močové potřebujeme k ochraně. Souvisí to i s hladinami volných mastných kyselin určených ke spálení. Jejich zvýšená hladina signalizuje problémy se spalováním tuků a vede k zadržování kyseliny močové v krvi. Pokud větší zadržování a následné zvýšení hladiny urátu aktivuje polyolovou dráhu, ta aktivuje rychlejší ukládání přebytečných kalorií do tukových zásob, mohl by to být docela pochopitelný ochranný mechanismus.
Acetát možná aktivuje právě tyto ochranné mechanismy i při nižší hladině urátu. Tvorba urátu je spojena s vysokou produkcí peroxidu vodíku xantin oxidázou. Pokud tuto dráhu acetát potlačuje a nahrazuje jinými dráhami, sníží se oxidační stres. Ovšem jestli acetát chrání buňky i před osmotickým stresem, to nedokážu stanovit. Aktivace SIRT1 acetátem napovídá, že by to mohlo vést ke snadnější aktivaci AR a tedy i polyolové dráhy. Doposud jsem si myslel, že je to špatná reakce, ale asi i tak lze chránit buňky před přetížením.
Je tedy aktivace aldozo reduktázy a polyolové dráhy prospěšná? Zásadní otázka, že?
Stačilo jen lépe hledat, lépe se ptát.
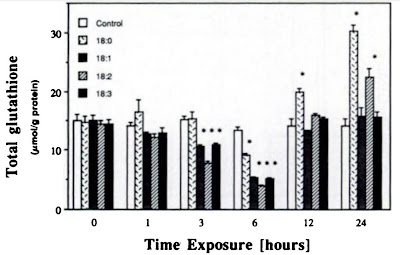
Ano, v určitých situacích rozhodně ano. V jakých? Aldózo reduktáza (AR) odbourává velice dobře nejen glukózu, ale i peroxidované lipidy (>1000krát lépe), zejména HNE (4-hydroxy-2-nonenal) a komplexy kdy HNE je spojeno s redukovaným glutathionem (GSH). Pomáhá tedy odbourávat produkty oxidačního stresu vzniklé nadměrným obsahem omega-6 v membránách. Navíc přítomnost těchto produktů peroxidace lipidů aktivuje expresi AR, podporuje syntézu hlavního enzymu polyolové dráhy a tento enzym pak pomáhá s odstraňováním peroxidovaných lipidů. Zvýšená produkce fruktózy je tedy pouze vedlejším efektem. Krásně nám to zapadá do situace, kdy vyřazení zpracování fruktózy KHK-KO potlačí oxidační stres, zachová antioxidační systém na bázi GSH, potlačí produkci oxidovaných lipidů a ty potom neaktivují AR, tak jak to vidíme na obrázku výše.
Pro aktivaci polyolové dráhy je sice důležitá zvýšená hladina glukózy, která ji dokáže spustit, ale množství vytvořených enzymů a skutečná aktivita AR a polyolové dráhy se rapidně zvýší až v přítomnosti produktů peroxidace linolové kyseliny omega-6, tedy peroxidaci rostlinných olejů uskladněných ve fosfolipidech buněčných membrán. Pak teprve polyolová dráha ztrácí svou ochrannou funkci, kdy má chránit před osmotickým stresem a přebytkem glukózy, a stává se aktivátorem odbourávání AMP/IMP, aktivátorem produkce H2O2, aktivátorem peroxidace lipidů a způsobuje zvýšené hladiny kyseliny močové. Zvýšená aktivace KHK a produkce endogenní fruktózy je jen vedlejším efektem potřeby odstraňovat produkty peroxidace polynenasycených tuků, oxilipiny. Bohužel tento vedlejší efekt způsobí další zvýšení oxidačního stresu. Tak se nám to nějak zacyklilo, že?
Pokud acetát/ocet aktivuje přes SIRT1 polyolovou dráhu enzymem AR a aktivuje tak odbourávání toxických aldehydů jako je např. HNE, pak se liší účinek octa podle hladiny glukózy v krvi. Při vysoké hladině může ocet aktivovat také produkci endogenní fruktózy a potlačit tak spalování tuků. Při nízké hladině glukózy naopak podpoří detoxikační aktivitu enzymu AR a podpoří spalování tuků. Doplnil bych tedy, že lepší bude asi vždy aplikovat ocet alespoň jednu hodinu před jídlem. Po jídle by zvýšená hladina glukózy mohla vést k nežádoucím účinkům užívání acetátu/octa, jako třeba nabírání tuku.
Zdroje:
AMPD2 plays important roles in regulating hepatic glucose and lipid metabolism
ALDOSE REDUCTASE: New Insights for an Old Enzyme
Aldose reductase functions as a detoxification system for lipid peroxidation products in vasculitis






Komentáře
Okomentovat