Inzulinová rezistence je způsobena nedostatkem peroxidu vodíku v buňce!
Peroxid vodíku H2O2 zvyšuje fosforylaci (aktivaci) a zpomaluje defosforylaci (deaktivaci) inzulinového receptoru, tím zvyšuje jeho citlivost na inzulin a snižuje inzulinovou rezistenci. Nevěříte? Ale nejen to, zároveň také udržuje v činnosti potlačení citlivosti inzulinového receptoru poté, co se potkal s vysokou hladinou inzulinu, může tedy i udržovat inzulinovou rezistenci. Tak pojďme se na to podívat blíže. Bez detailů z vědeckých studií se neobejdeme, ale žádný strach. Pokusím se tuto moji zatím asi kacířskou myšlenku nějak srozumitelně podat. V podstatě velmi podobné vysvětlení jsem psal již před dvěma roky, jen tam chyběl adaptivní mechanismus inzulinových receptorů, který byl tehdy neznámý.
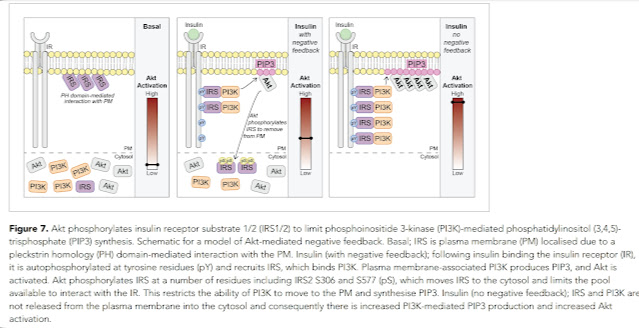 |
| Schéma inzulinového receptoru s negativní zpětnou vazbou plnící funkci komprese signálu. |
Začneme nejprve vysvětlením, co je inzulin. Je to látka, která umožňuje ukládání zásob energie. Když se najíte, beta buňky slinivky břišní vypustí do krevního oběhu signál, že je třeba přebytečné palivo uložit jako glykogen nebo tuk. V tomto stavu se hladina inzulinu pohybuje vysoko a ještě výše, pokud máte inzulinovou rezistenci. To je jeden stav, při kterém vaše tělo používá inzulin k řízení metabolizmu. Tento stav plynule přechází na stav mezi jídly, stav půstu. V tomto stavu je hladina inzulinu nízká, ale není nulová, protože inzulin i za této situace ovládá metabolizmus. Podílí se na řízení lipolýzy, tedy uvolňování volných mastných kyselin z tukových zásob a také ovládá tzv. glukoneogenezi, tvorbu nového krevního cukru např. z bílkovin, pokud už je všechen uskladněný cukr spotřebován. Rozdíl hladin inzulinu mezi těmito dvěma stavy je velký, může to být i víc než stonásobek. Aby regulace mohla probíhat za všech podmínek, buňky používají speciální inzulinové receptory se signálovou kompresí.
 |
| Funkce kompresoru signálu, pokud se nastaví dlouhý čas Release Time, pak se citlivost (Gain) sníží na dlouhou dobu po jakékoli signálové špičce. |
Musíme si tedy nejprve objasnit, jak funguje komprese signálu. Nejvíce se kompresory signálu používají při zpracování zvuku ve studiích i na pódiu. Jako příležitostný zvukař s tím mám určité zkušenosti, nastavit správně kompresor tak, aby se zvuk uhladil a byl příjemný, aby posluchač vlastně vůbec nepoznal, že zvuk prochází přes kompresi, není tak snadné. Kompresor normálně zvuk zhutňuje, hudba nebo řeč se pak zdá být hlasitější, ale špatně nastavený kompresor může signál ztišit, může způsobovat nestabilitu hladiny zvuku a tedy situaci velmi pokazit. Pokud je nastavena velmi dlouhá relaxační doba, můžete krátkým hlasitým úderem bubnu vyvolat potlačení signálu na dlouhou dobu. A to se může stát i s inzulinovým receptorem.
Inzulinový receptor je umístěn v buněčné membráně a pracuje tak, že přichycená molekula inzulinu aktivuje molekulu AKT na druhé straně membrány pomocí řízené fosforylace prostřednictvím molekul IRS a PI3K. ta poslední aktivuje AKT a ta pak spouští všechny potřebné procesy. Kromě toho ale také aktivuje označení a přesun molekul IRS pryč z buněčné membrány do cytosolu tak, aby byly méně dostupné. To sníží citlivost receptoru na inzulin, což je reakce na silnou stimulaci inzulinem. Pokud inzulinový signál odezní, obnoví se za nějakou dobu původní citlivost. To ovšem platí pouze za předpokladu, že se do nastavení parametrů nebude plést nějaký vetřelec! Třeba peroxid vodíku, který zvyšuje fosforylaci receptoru a zpomaluje jeho relaxaci, tedy návrat na původní citlivost. Ale on to vlastně není vetřelec, protože když chybí úplně, je to také špatně. Musí ho být tak akorát, už jsem se o tom jednou zmiňoval v souvislosti s řízením buněčného metabolizmu.
 |
| Peroxid vodíku zabraňuje defosforylaci (deaktivaci) míst aktivovaných inzulinem. |
 |
| Peroxid vodíku zesiluje fosforylaci (aktivací) míst aktivovaných inzulinem. |
Co se stane, když bude málo peroxidu vodíku? Receptor vůbec nezareaguje, bude stále relaxován. Rychlost defosforylace receptoru a jeho relaxace je bez peroxidu tak vysoká, že to způsobí jen velice malou a krátkou reakci na inzulin. Jedná se prakticky o stav inzulinové rezistence. Píše se o tom ve studii na myších. Geneticky upravené myši se zvýšenou aktivitou glutathion peroxidázy mají inzulinovou rezistenci. Proč? Mají v buňkách nedostatek peroxidu vodíku.
 |
| Porovnání myší s geneticky zvýšenou aktivitou glutathion peroxidázy GPX1 (OE) s neupravenými (WT). Zkoumán vliv na krevní cukr, celkovou hmotnost a hmotnost tukové tkáně. |
 |
| Porovnání myší s geneticky zvýšenou aktivitou glutathion peroxidázy GPX1 (OE) s neupravenými (WT). Zkoumán vliv na citlivost jaterních inzulinových receptorů. |
K tomuto stavu dochází pravděpodobně i při pseudohypoxii, kdy oxidační procesy jsou nahrazeny fermentací a nedochází k produkci superoxidu O2-. Při tom dojde k zapnutí mnoha genů, které zvýší syntézu tuků i proteinů a které nejsou řízeny inzulinem, celkově to způsobí obezitu a jiné problémy. Další častou možností, jak docílit patologicky nízké hladiny H2O2, je aktivovat glutathion peroxidázu pomocí tuků. Je to jako u výše zmíněných myší, jen se to neprovede geneticky, ale stravou. Umí to provést např. nadbytek volných mastných kyselin v krvi, které se uvolní ráno z vašich tukových zásob, zejména přebytek linolové kyseliny. Ještě více se to projeví při půstu nebo při ketogenní dietě, kdy se uvolňuje do krve mnoho tuku, zejména u obézních lidí. Volné mastné kyseliny mají totiž velkou schopnost aktivovat glutathion peroxidázu a odbourávat tedy rychle peroxid vodíku. Je to normální obrana, protože při spalování tuků se vždy produkuje více superoxidu než při spalování glukózy. Ten problém je ale v tom, že v našem uloženém tuku máme mnohonásobně více linolové kyseliny omega-6, než mívali naši předci. Projeví se to tak, jak je vidět na analýze svalových buněk obézních lidí s inzulinovou rezistencí. V našem soukolí enzymů se pohybuje „písek“ ve formě aldehydů jako produktů sekundární autooxidace polynenasycených tuků. Ty narušují činnost druhého mitochondriálního komplexu (např. malonát z MDA blokuje sukcinát debydrogenázu SDH) a tak znesnadňují spalování tuků, snižují množství vyprodukovaného superoxidu a peroxidu vodíku. Navíc i zvyšují hladinu volných mastných kyselin, tak zvyšují aktivitu glutathion peroxidázy a ještě více snižují hladinu peroxidu vodíku, což jak už víme, zrychluje relaxaci inzulinových receptorů a snižuje jejich citlivost.
A v tomto stavu si dáme ráno snídani plnou rychlých sacharidů. Inzulin skokově vzroste, ale při malé citlivosti receptorů způsobí zvýšení hladiny glukózy, ta se tak dostane do nepřipravené buňky a začne produkovat velké množství superoxidu a peroxidu vodíku. To způsobí jednak další autooxidaci linolové kyseliny na aldehydy („písek“) ale způsobí hlavně zvýšení citlivosti a zpomalení reakcí inzulinových receptorů. Ty jsou v tuto chvíli nastavené na silný signál a snaží se jej maximálně utlumit, Tato situace se zafixuje na delší dobu a receptory zůstanou potlačené. Po určité době po jídle dojde k relaxaci receptorů, ale ty se vrátí do druhého extrému, nízké citlivosti způsobené nedostatkem peroxidu vodíku. Existují tedy dva stavy inzulinové rezistence, jeden je vyvolán nedostatkem peroxidu při půstu (nebo keto dietě) a druhý je vyvolán nadbytkem peroxidu při jídle. Mezi těmito stavy může existovat i krátká chvíle, kdy je hladina peroxidu normální a receptory mohou fungovat správně, ale je to zcela nevýznamné. Správná činnost inzulinových receptorů vyžaduje správné množství peroxidu vodíku, tedy ani málo, ani moc.
Toto cyklování probíhá stále, od jednoho stavu inzulinové rezistence k druhému. Jak se dostat z tohoto cyklu ven již víme. Jsou to oxidační terapie. Zejména před jídlem, kdy zvýší citlivost inzulinových receptorů v době, kdy jsou ovládány nedostatkem peroxidu způsobeným nadměrnou aktivitou glutathion peroxidázy. Už jsem to zde mnohokrát probíral, existují terapie silně zředěným peroxidem vodíku nebo ozonové terapie. Nyní už víme, že mají smysl. A máme i mechanistické vysvětlení, jak přímo ovlivňují tak podivné chování buněk, jakým je inzulinová rezistence. Stejný efekt na zvýšení citlivosti inzulinových receptorů má i doplňování MCT oleje, zejména během dopoledne před hlavním jídlem. Přímý efekt snížení inzulinové rezistence je měřitelný a každý si to může vyzkoušet podle tohoto postupu.
Dodatek:
Fruktóza (cukr) blokuje činnost enzymu PKM2 a tak snižuje při nedostatku kyslíku tvorbu peroxidu vodíku na PDHC a blokuje zásobování mitochondrií pyruvátem. To aktivuje HIF-1, metabolizmus buňky se změní a zvyšuje se tak pravděpodobnost přežití buněk při hypoxii. Zvýší se tak i riziko rakoviny a to znamená, že nedostatek H2O2 je opravdu velký problém. Viz následující příspěvek.
Zdroje:
Hydrogen Peroxide Flips the Switch - Fire In A Bottle
Development of insulin resistance and obesity in mice overexpressing cellular glutathione peroxidase
Akt phosphorylates insulin receptor substrate to limit PI3K-mediated PIP3 synthesis



Komentáře
Okomentovat