Stárnutí a co ho způsobuje. Pomáhá omezení kalorií?
Stárnutí se týká každého, ať se stará nebo nestará. Může nám to být jedno, ale v každém případě je to velmi zajímavý fenomén. Zatím není moc jasné, jak ho zpomalit, zastavit, nebo dokonce otočit? Některé výsledky pokusů na zvířatech nám určitý směr naznačují, ovšem nejdříve bychom si měli ujasnit, co to vůbec stárnutí je a jak ho měřit. To není jednoduchý problém. Nejjednodušší je odměřit dobu od narození do současnosti. Ale to asi není to, co nás zajímá. My chceme vědět, jak si stojíme vzhledem k ostatní podobné populaci. Jestli jsme více opotřebovaní, nebo méně. Jestli s nějakou pravděpodobností vydržíme déle na živu než ostatní, nebo jestli ne. Pojďme se na to podívat pomocí studií a logických úvah.
Takže nejprve bychom si měli ujasnit, co je pro nás měřítkem stárnutí. Asi by to mohlo být např. zdraví. Nechceme být sice dlouholetí, ale být upoutáni na lůžku a nevědět o sobě, s nefunkčním pohybovým aparátem a mozkem. To není dobrá vize dlouhověkosti. Chceme být aktivní a zdraví. Chceme mít všechny orgány plně funkční, chceme mít všechny potřebné buňky plně funkční. Jak takový stav měřit? Co třeba měřit sílu svalů? Nebo rychlost chůze? To už jsem zde probíral v souvislosti s účinky doplňování glycinu a NAC, tedy doplňování součástí glutathionu (GSH), hlavního antioxidantu na odstranění H2O2 vznikajícího při produkci energie oxidační fosforylací. Tam to fungovalo dobře a pětasedmdesátníci skvěle omládli. Je to dobrá stopa, budeme ji sledovat.
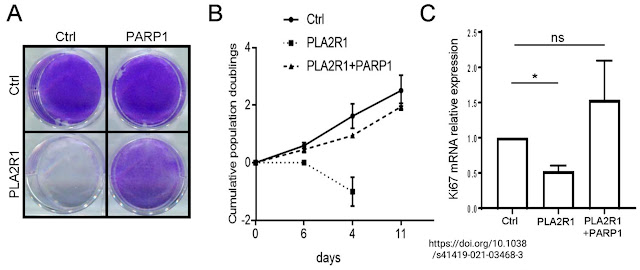
Další důležitou stopou je buněčná senescence, tedy buněčné stárnutí. To lze identifikovat pomocí proteinů, např. p21. Už dokonce tušíme, jak ji aktivovat, jde to oxidačním stresem, např. H2O2. Mechanizmus už také tušíme, účastní se ho enzym fosfolipáza A2 (PLA2). Enzym, který odděluje z membránových fosfolipidů volné mastné kyseliny, signalizační molekuly pro další enzymy, které např. mohou ovládat i rozpojení (uncoupling, UCP).
Pokud se v této situaci uvolňují místo olejové kyseliny produkty auto-oxidace PUFA (např. 4-hydroxy-2-nonenal HNE), pak se spustí buněčná senescence. Takže co provede deaktivace enzymu PLA2? Oxilipiny se neuvolní, senescence nenastane. PLA2 se aktivuje peroxidem vodíku. Co provede doplnění antioxidantů? Také potlačí senescenci. Podívejme se na studii. Vidíme jasně, že vypnutí PLA2 (Pla2r1 KO) omezuje změny metabolismu související se stárnutím. Zůstává zachována antioxidační ochrana, zůstává citlivost na inzulín.
 |
| Vypnutí PLA2 (KO) omezuje vznik buněčné senescence p21 při kontrolní (CD) i tučné (WD) stravě. |
 |
| Vypnutí PLA2 (KO) zamezí změnám v metabolismu glukózy souvisejícím se stárnutím (Old). |
Opustíme nyní PLA2 a podíváme se na jinou studii o mechanizmu stárnutí. Autoři vysvětlují mechanizmus stárnutí logicky a dokládají své úvahy i experimentálně. Jde o poškození DNA související se zpomalením opravných mechanizmů. Obecně máme představu, že naše DNA je neměnná, uschovaná v buněčném jádru. Naše prostředí je a vždy bylo ne zcela přátelské. Například jsme, a v minulostí jsme byli zřejmě daleko více, vystavení ultrafialovému a radioaktivnímu záření. Musíme počítat i s radioaktivním zářením běžných nerostů, zbytky kosmického záření apod. Naše DNA je tedy dennodenně poškozována v každé buňce našeho těla. Naštěstí máme v každé buňce celou řadu opravných mechanizmů. Ty se starají tak dobře o naši DNA, že tyto vlivy vlastně vůbec nepociťujeme. Jiné je to v případě vrozených genetických poruch některého z opravných mechanizmů. Tito lidé se, pokud jim porucha vůbec umožňuje přežít, musí chránit před UV zářením, radiací apod. Může to pro ně být fatální.
 |
| Dlouhé sekvence RNA s poruchami blokují RNA polymerázu, tak se mění poměry mezi proteiny a dochází k nedostatečné transkripci dlouhých genů na proteiny. |
Genetický kód je dlouhý, ale pro potřeby výroby enzymů se vždy používá jen relativně krátký úsek, rozmotá se, zkopíruje se do RNA, ta opustí jádro a slouží jako děrná páska pro stroj na výrobu proteinů, RNA polymerázu. Pokud je informace v DNA v pořádku, složí se správná sekvence, která po poskládání funguje jako nový enzym, nový nano-stroj. S postupujícím časem se i přes opravné mechanizmy v DNA objeví chyby. Čím delší je kód, tím je větší pravděpodobnost chybné sekvence. Chyba v sekvenci způsobí, že stroj na sestavování proteinů se zasekne. Přestane produkovat nové proteiny. Postupně k němu přijedou další RNA polymerázy a vznikne zácpa jako na dálnici. Kratší sekvence mají méně poruch, delší mají poruch více. To způsobí změny v poměrech přítomnosti enzymů. To způsobí změny v expresi genů. Některé tyto změny jsou poměrně dobře prozkoumány a používají se jako měřítko stárnutí.
Co z toho vyplývá? Pokud chceme zpomalit stárnutí, měli bychom chránit naši DNA ve všech buňkách před vetřelci, kteří nám DNA poškozují. Radiační pozadí asi příliš neovlivníme, ale UV záření ano. Ale proč lze ovlivnit stárnutí vypnutím PLA2? Vypnutím PLA2 přece neodstraníme prvotní příčinu, tedy H2O2 z oxidační fosforylace. Nejpravděpodobnější mechanizmus bych viděl tak, že i když budou fosfolipidy v membránách zoxidované, problém nastane až při jejich uvolnění. Souvisí to také s tím, že pokud dokážeme zachovat spalování tuků, spálí se i oxilipiny.
Je otázka, zda poškození DNA je způsobeno omezením opravných mechanizmů nebo přímo oxidačním stresem. Já bych se přikláněl spíš k první variantě, že oxilipiny zpomalí činnost opravných enzymů. Víme, že HNE se velice aktivně přichytává k různým enzymům, zpomaluje nebo zastavuje jejich funkci. Pokud se tedy přichytí na opravné enzymy, ty nebudou moci opravovat DNA a poškození zůstane nevyřešené. Počkejte, co jen mi to připomíná? Ano, to je princip buněčné senescence! Buňky zastaví dělení a čekají na opravu poškozené DNA, protože rozpletená DNA už nejde opravit, ztratila by se informace ze sousedního vlákna.
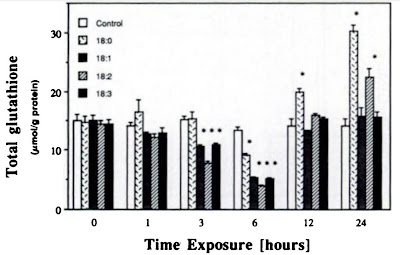
Tak si to zopakujme. Naše membrány se postupně plní polynenasycenými fosfolipidy, které nahrazují ty mononenasycené. Z těchto fosfolipidů uvolňuje PLA2 podle potřeby (vyšší hladinou H2O2) volné mastné kyseliny. Jejich složení se ale s věkem mění, postupně přibývá arachidonové kyseliny, která zoxiduje např. na HNE, tak ale potlačí funkci mnoha enzymů, i těch, které opravují DNA a spalují tuky. Pokud PUFA ponecháme v membránách, k potlačení funkce nedojde. Stárnutí se zpomalí. Pokud se přece jen z membrán PUFA uvolní, je třeba mít funkční antioxidační systém, tedy dostatek GSH a NADPH. Pokud se podaří zamezit buněčné senescenci, zpomalí se i celkové stárnutí. Ne všechny orgány stárnou stejně rychle, délku života omezuje orgán, který stárne nejrychleji.
Podívejme se nyní na studii, která zkoumala vliv omezení kalorického příjmu na délku života. Závěrem je, že opravdu omezení kalorií může vést k prodloužení života, nejvíce u zvířat, která nejvíce tloustla na neomezeném příjmu kalorií. Pokud se zamyslíme, celá studie je vlastně o škodlivosti přejídání. Omezení kalorického příjmu pouze normalizuje příjem na hodnotu na přirozené stravě. Uměle vytvořená strava, rychlé sacharidy upravené na maximální stravitelnost, vedou k přejídání, vedou k nedostatečnému naplnění zásob jaterního glykogenu, které toto přejídání způsobí. Přebytek paliva v buňce způsobí nárůst peroxidu vodíku a buňka by měla za této situace spustit PLA2, uvolnit mononenasycenou kyselinu olejovou z fosfolipidů a to by mělo spustit mitochondriální rozpojení (uncoupling), tedy cíleně mařit energii na teplo. Ale pokud je v membránách arachidonová kyselina v nadbytku, už víme, že to spustí buněčnou senescenci, tedy zrychlené stárnutí. Je to jen jiný druh ochrany.
 |
| Čím větší přejídání, tím kratší život a větší efekt kalorického omezení stravy. Špatné jídlo se musí úmyslně omezovat, aby neškodilo. Správné jídlo je přijímáno správnou rychlostí bez přejídání. |
 |
| Omezení kalorického příjmu zachová antioxidační systém fungující pomocí GSH a NADPH déle funkční. Myši ve vyšším věku (22 měsíců, černý sloupec) mají obnovu GSH dostatečnou, pokud se nepřejídají. |
Závěr by mohl být takový, že pokud se chceme dožít vysokého věku, musíme zabránit vzniku buněčné senescence. Způsobů, jak spustit proces buněčné senescence, je více. Nejběžnějším mechanizmem je ultrafialové záření, radiace, ztráta antioxidační ochrany a otrava produkty autooxidace omega-6 linolové kyseliny.
Doplnění
Přidal jsem reference na studie souvislosti PLA2 a PARP-1. Výše navrhovaný mechanizmus se tedy jeví jako možný, aktivace PLA2R1 pomocí H2O2 potlačuje opravu DNA tím, že potlačuje enzym PARP-1. Potlačení PARP-1 zvyšuje senescenci a snižuje množství ROS. To se jeví jako vhodná metoda na snížení peroxidace polynenasycených fosfolipidů a souvisí s poklesem hladiny HNE. Projeví se to pozitivně i na modelu autismu u myší, ovšem hlavním pachatelem může tedy být příliš vysoký obsah polynenasycených fosfolipidů v membránách, který spouští senescenci nebo buněčnou smrt. Pokud by v membránách převažovaly stabilní mononenasycené fosfolipidy, nedošlo by k přílišnému navýšení ROS a nemusela by tedy být spuštěna buněčná senescence k jejich snížení.
Na obrázcích ze studií si uložím nějaké myšlenky, abych je nezapomněl.
Zdroje:
Caloric restriction and the aging process: a critique
Genome-wide RNA polymerase stalling shapes the transcriptome during aging
Reduced Circulating Insulin Enhances Insulin Sensitivity in Old Mice and Extends Lifespan
PLA2R1 promotes DNA damage and inhibits spontaneous tumor formation during aging








Komentáře
Okomentovat